早发型帕金森病(EOPD)——常见病中的罕见病
疾病概述
帕金森病(Parkinson disease,PD)是中老年常见的神经系统变性疾病,在生活中多见于一些上了年纪的老大爷、老大妈。他们常常拥有明显的静止震颤、动作迟缓及减少、肌张力增高、姿势不稳等症状。但近年来早发型帕金森病发生率逐渐升高,引起临床医生的普遍重视。非运动症状在PD的疾病进程中非常常见,部分先于运动症状出现,并随疾病的进展加重,严重影响PD患者的生活质量。所以今天我们介绍一下这种常见病中的罕见病——早发型帕金森病。
图1.图源来自网络
帕金森病(PD)总体而言是多发于老年人群的神经退行性疾病,其临床表现包括运动迟缓、静止性震颤、肌强直等运动症状及自主神经功能障碍、睡眠障碍及认知障碍等非运动症状。众多研究表明PD是一种临床异质性较大的疾病,不同分型的患者临床表现存在差异。其中发病年龄小于50岁的帕金森病被称为早发型帕金森病(early-onset Parkinson’s disease,EOPD)。与原发性PD(idiopathic Parkinson's disease,iPD)或晚发型PD(late-onset Parkinson's disease,LOPD)相比,EOPD的发病年龄早,病程长,临床表现异质性大,症状相对不典型,易被忽视和误诊;虽对小剂量左旋多巴制剂的反应好,但更容易出现运动并发症[1]。
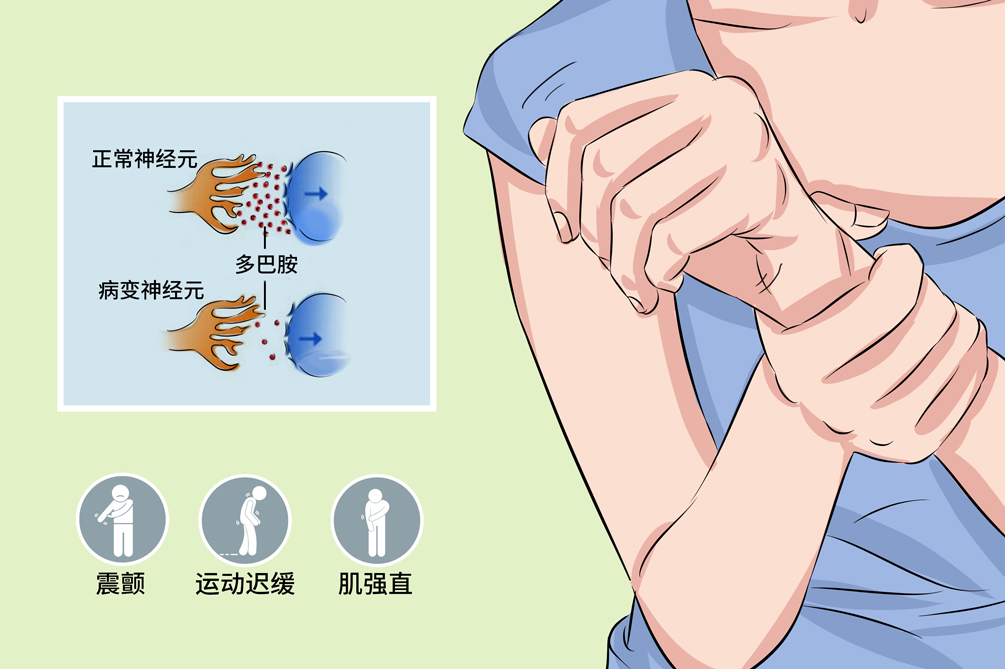
图2.EOPD症状[2]
流行病学
在整个帕金森病患群体中,早发型帕金森病较少见,发病率占帕金森病人数的5%~10%,在欧美国家中约为5%,在日本约占10%。早发型帕金森病与晚发型帕金森病相似,发病率随着年龄的增加而增加。但与晚发型帕金森病不同的是,早发型帕金森病大多具有明确的遗传易感性和家族聚集性,多数具有阳性家族史,提示遗传因素在其中起到重要作用。目前已有20多个基因明确定位,包括常染色体显性和隐性遗传两种主要遗传方式。
其相关致病基因包括:常染色体显性遗传基因:SNCA、LRRK2、UCH-L1、VPS35等;常染色体隐性遗传基因:Parkin、PINK1、DJ-1、ATP13A2、PLA2G6等;易感基因:不直接致病,在正常人群中也可检出,但是其存在增加PD的发生风险,例如GBA、MAPT、SNCA等。多个易感基因携带者发生PD的风险显著增高,提示多个微效基因的叠加效应。此外,易感基因之间还存在交互作用。
发病机制
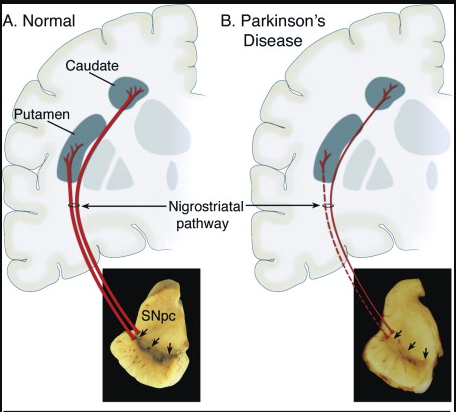
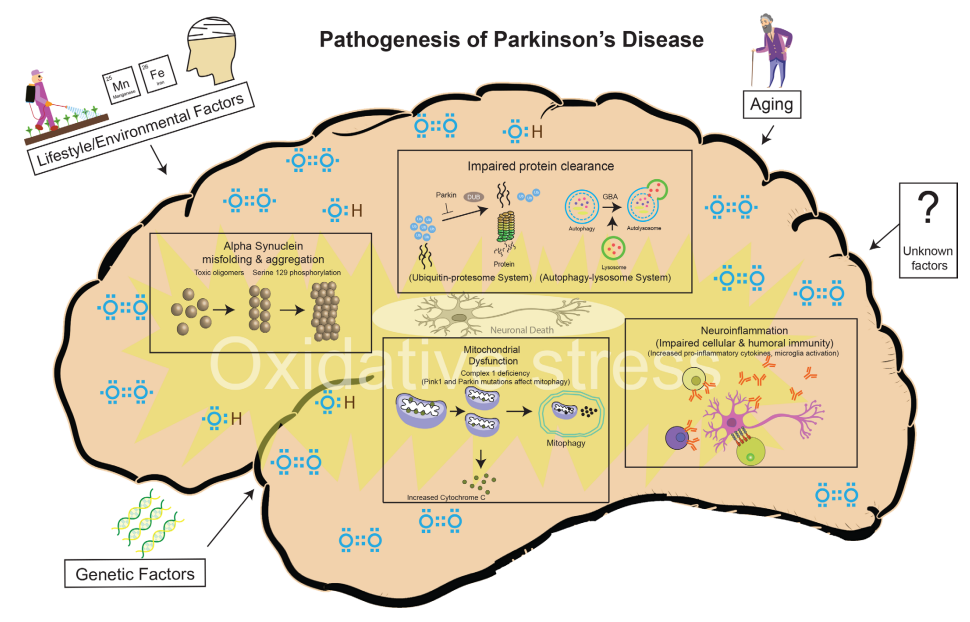
帕金森病的临床病理特征主要表现为患者的中脑特定脑区黑质致密区(SNpc)多巴胺(DA)能神经元大量凋亡,且存活的神经元内出现由α-突触核蛋白(α-Syn)错误折叠、聚集所形成的路易小体(Lewy Body,LB),纹状体DA表达水平降低。据WHO报道,目前针对PD致病机理的主流学说包括神经炎症学说、α-Syn蛋白的错误折叠及过表达学说、氧化应激学说、线粒体功能障碍学说等[3]。
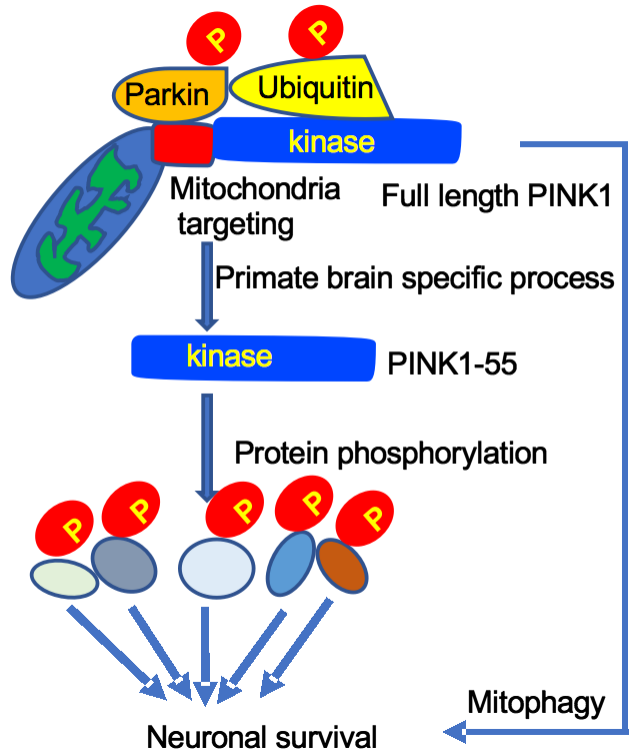
近期,联盟专家李晓江教授是国际著名神经退行性疾病专家,他所带领的团队研究发现遗传性帕金森疾病新机制:揭示了PINK1蛋白与帕金森疾病的关系,即PINK1蛋白在灵长类大脑中并非聚集在线粒体位置,而是作为激酶主要存在于胞浆中。在正常非应激状态下,PINK1的作用则是通过磷酸化脑部的相关神经蛋白,保护脑部神经元免受损伤,为治疗帕金森疾病提供了新的思路及依据。
图3.健康人与PD患者的黑质致密区多巴胺神经元存活状态对比[4]
图4.α-突触核蛋白的聚集情况对比[5]
图5.PD发病因素及致病机理[3]
图6.灵长类脑组织中的PINK1主要作为激酶磷酸化蛋白而维持神经细胞生存,
而体外培养细胞在线粒体应激后PINK1主要发挥线粒体自噬功能[8]
临床表现
EOPD具有iPD的一般临床特征,也具有其自身特点。EOPD的发病年龄较早(≤50岁),最早可于7岁发病;病程长且疾病进展缓慢。发病年龄越大的患者,其临床表现越趋近于iPD;发病年龄较早的患者,其临床表现相对不典型。多数患者对左旋多巴制剂的反应良好,但异动症和症状波动的发生率高且出现较早[6]。
(一)运动症状
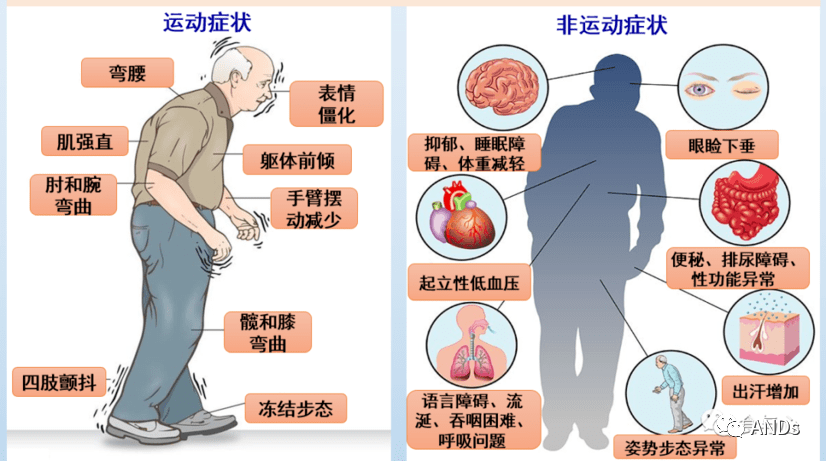
EOPD具有运动迟缓、肌强直、静止性震颤及姿势步态异常等iPD的运动特征,症状可有晨轻暮重、睡眠休息后减轻现象。EOPD的首发症状以运动迟缓多见,也可以肌张力障碍为首发症状。EOPD以强直少动症状为主要表现,静止性震颤、早期平衡功能障碍相对少见;部分患者可伴有肌张力障碍,多见于足部或下肢的局灶型肌张力障碍。
(二)非运动症状
EOPD也会出现不同程度的非运动症状,包括神经精神症状、睡眠障碍、认知功能障碍、便秘等,以抑郁、不宁腿综合征、成瘾行为较多见,而认知功能障碍、神经精神症状、幻觉等相对少见,嗅觉功能相对保留较好。
图7.PD临床症状[7]
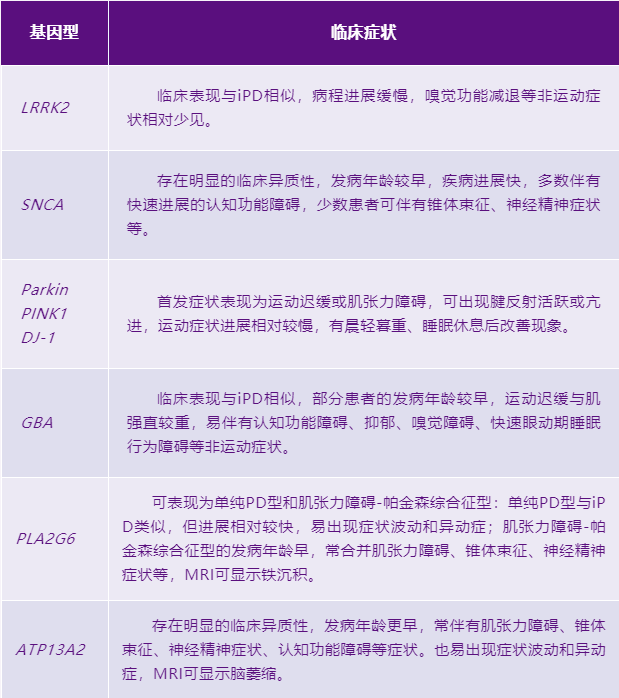
(三)基因型-临床表型
表1.基因型-临床表型
疾病诊断
(一)血清学检查
血清铜、血清铜蓝蛋白等检查有助于与肝豆状核变性(hepatolenticular degeneration,HLD)鉴别诊断。
(二)电生理检查
肌电图震颤检测有助于震颤频率、振幅、类型的分析与评估。
(三)嗅觉评估
Sniffin's Sticks测试等有助于嗅觉功能评估。
(四)神经影像学检查
结构性颅脑CT和MRI常规序列检查在EOPD患者中无特征性改变,但是对于EOPD与HLD、脊髓小脑性共济失调(SCA)、亨廷顿病(HD)、脑组织铁沉积神经变性病(NBIA)等的鉴别诊断具有一定价值。
(五)心脏间碘苄胍闪烁显像
心脏间碘苄胍闪烁显像可显示心脏去交感神经支配,有助于临床诊断,但是在EOPD中的提示作用可能不如iPD。
(六)临床评分量表
量表评估有助于了解EOPD患者的临床症状及其严重程度。国际运动障碍学会帕金森病综合评定量表(MDS-UPDRS)、Hoehn-Yahr分期量表等可以评估患者的运动症状、运动并发症及病情严重程度等;非运动症状评定量表(NMSS)、简易精神状态评价量表(MMSE)、蒙特利尔认知量表(MoCA)、汉密尔顿抑郁量表(HAMD)等可评估患者的非运动症状;可根据情况选用某一类专门的评分量表对某一特定方面进行详细评估。
表2.2015 MDS-PD诊断新标准[9]
(七)基因检测
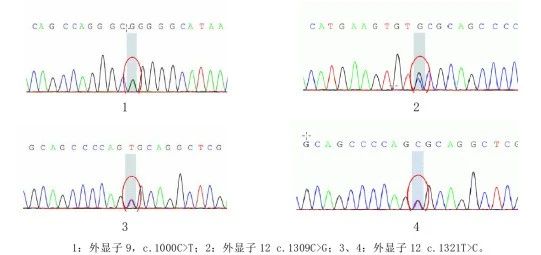
基因检测可以明确病因,协助诊断与鉴别诊断。在进行基因检测之前需要进行遗传咨询,根据有无家族史、发病年龄、临床表型等进行个体化基因检测[6]。
图8.4例散发parkin基因位点突变点图[9]
动物模型
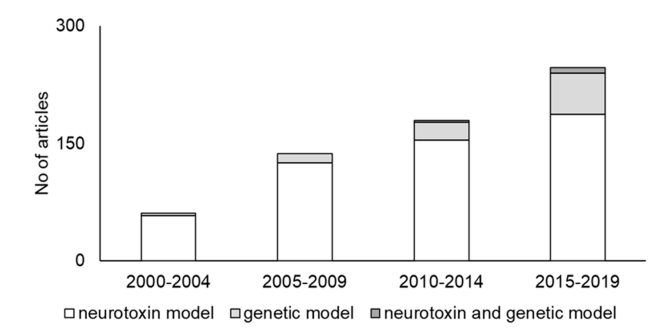
近年来,人们对帕金森病的神经生物学机制、遗传及环境因素有了更加深入的了解,但帕金森病的新药研发之路还是困难重重,可用的生物标志物、良好的药物靶点及遗传基础等因素的探索缺乏均给药物研发带来了阻碍。因此,合适的疾病小鼠模型是推动PD机制研究和新药开发不可或缺的工具。PD的动物模型主要有两种模型构成:神经毒素模型和基因编辑模型,也有少部分文献选用神经毒素与基因编辑复合模型,其中神经毒素模型应用最为广泛[10]。
图9.不同类型PD模型的选择数量和趋势[10]
(1)神经毒素模型[11]
在神经毒素模型中,最常使用神经毒素的是6-OHDA和MPTP,神经毒素模型造模手段多为全身性注射神经毒素或脑内注射神经毒素,不同的神经毒素模型,所能模拟的PD病理特征各有不同。
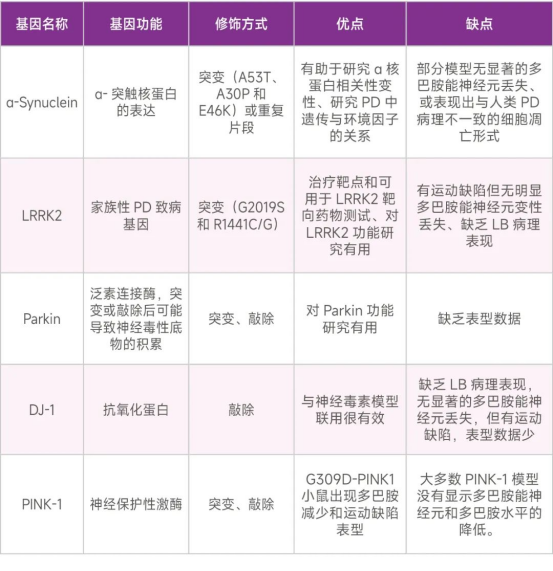
(2)基因编辑模型[12]
遗传学在PD发病机制中也发挥着重要作用。通过对家族性PD和特发性PD的分析确定了PD存在以下致病基因:SNCA(表α-Synuclein应为SNCA)、Parkin、DJ-1、PINK1和LRRK2。
表3.PD存在以下致病基因
治疗方式
在治疗方面,由于患者年轻,病程较长,容易伴随情绪障碍,故推荐药物、心理、康复等多方面综合治疗和管理[12]。
(一)抗PD药物治疗
1.左旋多巴制剂:如多巴丝肼、卡左双多巴控释片、左旋多巴/卡比多巴肠内凝胶等。EOPD患者对左旋多巴制剂的反应良好,左旋多巴制剂可显著改善运动症状,但相对容易出现运动并发症。
2.非麦角类DR激动剂:如吡贝地尔、普拉克索、罗匹尼罗、罗替高汀等,可作为不伴智能减退的EOPD患者的单药治疗药物,非麦角类DR激动剂可有效控制EOPD患者的症状,更适用于病程初期的EOPD患者,但患者较易出现与非麦角类DR激动剂相关的发作性睡眠及冲动控制障碍。
3.MAO-B抑制剂:如司来吉兰和雷沙吉兰,亦可作为不伴智能减退的EOPD患者的单药治疗药物;也可作为左旋多巴制剂的联合药物,特别是对于症状波动的EOPD患者。
4.COMT抑制剂:如恩他卡朋、恩他卡朋双多巴等,恩他卡朋可与多巴丝肼等左旋多巴制剂联合用药,可提高左旋多巴的生物利用度,延长左旋多巴的临床疗效,改善EOPD患者的运动症状。
5.抗胆碱能药物:如苯海索,对EOPD患者的静止性震颤有效,无静止性震颤的EOPD患者不予推荐;长期服用可导致认知功能损害。
6.金刚烷胺:对运动迟缓、肌强直有一定作用,对改善异动症有一定帮助。
以上药物对于青少年期患者应慎用,儿童期患者不推荐使用。
(二)其他对症治疗药物
1.肌张力障碍的治疗:EOPD 可伴有肌张力障碍,可选用苯海索、地西泮、硝西泮、氯硝西泮、丙戊酸、巴氯芬、乙哌立松等药物,也可应用肉毒毒素注射治疗。
2.抑郁焦虑的治疗:可应用选择性5-羟色胺再摄取抑制剂(selectiveserotonin reuptake inhibitors,SSRIs)治疗,也可应用DR激动剂如普拉克索治疗。
3.精神症状的治疗:除抗PD药物的调整或停用外,可选用氯氮平或喹硫平进行治疗,前者的作用稍强于后者,但氯氮平可导致粒细胞缺乏症,需监测血细胞计数。
4.睡眠障碍的治疗:睡眠障碍主要有失眠、RBD、白日过度嗜睡(excessive daytime sleepiness,EDS)等,抗PD药物的合理使用有助于睡眠障碍的治疗,氯硝西泮有助于RBD的治疗。
5.认知功能障碍的治疗:可应用胆碱酯酶抑制剂,如利伐斯明、多奈哌齐等。
(三)靶向药物治疗
部分EOPD是由基因突变所致,基因靶向药物治疗是EOPD精准治疗的方向。针对携带LRRK2、SNCA、GBA、Parkin等基因突变的患者,相关基因靶向药物目前尚处在临床试验阶段。
(四)肉毒毒素治疗
关于EOPD的肉毒毒素治疗目前仍没有针对性的研究,主要参照《中国肉毒毒素治疗应用专家共识》,须遵照个体化原则制定合理的治疗目标及合适的治疗方案。A型肉毒毒素可有效改善震颤(B级~C级推荐)、肌张力障碍(A级~C级推荐)、自主神经功能障碍(A级~C级推荐)等症状。由于目前尚无充足证据证明妊娠期患者应用肉毒毒素的安全性,因而不推荐对妊娠期和哺乳期患者使用。
(五)脑深部电刺激术
脑深部电刺激术(deep brain stimulation,DBS)是抗PD药物治疗的一种有效补充手段。EOPD患者若病程进展缓慢、运动并发症较严重,可适用于DBS治疗。参照《中国帕金森病脑深部电刺激疗法专家共识》,对左旋多巴制剂反应良好的EOPD患者,若出现药物疗效减退、明显的运动并发症、不能耐受的药物不良反应,可选择DBS治疗。
(六)重复经颅磁刺激
重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种无创性神经调控方法。关于EOPD的rTMS治疗目前没有针对性的研究,主要参照国际临床神经生理学联盟制订的《基于循证医学证据的rTMS临床应用指南》,需遵循个体化治疗原则制定合理的刺激方案。rTMS对运动症状及非运动症状有一定的改善作用。
(七)运动锻炼与康复
运动锻炼与康复如语言及吞咽功能训练、步态训练、姿势平衡训练等可以有助于EOPD患者运动症状和非运动症状的改善。另外,太极拳、瑜伽、舞蹈、水疗等日常运动也有助于EOPD患者运动症状和非运动症状的改善。
(八)照料护理与心理疏导
对EOPD患者应做好疾病宣教、心理疏导工作,鼓励其正常工作,多参加社交性活动,同时科学护理、注意防止误吸或跌倒等意外事件会具有积极的辅助治疗作用。
(九)遗传咨询
遗传咨询是通过患者及家属提供的相关疾病与家族信息,运用系统的遗传分析原则与方法,为患者提供疾病与遗传特征信息,以帮助患者正确理解和适应遗传对疾病的影响,从而做出合理科学的医疗决定的过程。遗传因素与EOPD的发生有关,特别是有家族史的EOPD患者可能携带与PD相关的基因突变,因此临床医师、患者及其家属应重视EOPD的临床遗传咨询,这对提高人口素质具有重要意义。
声明:本文收集归纳的信息,如有错漏,欢迎批评指正!
参考文献及图片来源:
[1]王丹蕾,杨清梅,高红铃,李静怡,袁笑,薛峥,闵喆.早发型与晚发型帕金森病非运动症状与血生化指标水平分析[J].卒中与神经疾病,2020,27(06):782-786.
[2]https://m.youlai.cn/baike/mdisease/17PQBOXtM0.html
[3] Jankovic J, Tan EK. Parkinson's disease: etiopathogenesis and treatment. J Neurol Neurosurg Psychiatry. 2020 Aug;91(8):795-808. doi: 10.1136/jnnp-2019-322338. Epub 2020 Jun 23. PMID: 32576618.
[4] Dauer W, Przedborski S. Parkinson's disease: mechanisms and models. Neuron. 2003 Sep 11;39(6):889-909. doi: 10.1016/s0896-6273(03)00568-3. PMID: 12971891.
[5] Zhang QS, Heng Y, Mou Z, Huang JY, Yuan YH, Chen NH. Reassessment of subacute MPTP-treated mice as animal model of Parkinson's disease. Acta Pharmacol Sin. 2017 Oct;38(10):1317-1328. doi: 10.1038/aps.2017.49. Epub 2017 Jun 26. PMID: 28649132; PMCID: PMC5630672.
[6]早发型帕金森病的诊断与治疗中国专家共识[J].中华神经医学杂志,2021,20(02):109-116.
[7]https://www.sohu.com/a/614751676_139908
[8]Yang Weili,Guo Xiangyu,Tu Zhuchi,Chen Xiusheng,Han Rui,Liu Yanting,Yan Sen,Wang Qi,Wang Zhifu,Zhao Xianxian,Zhang Yunpeng,Xiong Xin,Yang Huiming,Yin Peng,Wan Huida,Chen Xingxing,Guo Jifeng,Yan XiaoXin,Liao Lujian,Li Shihua,Li XiaoJiang. PINK1 kinase dysfunction triggers neurodegeneration in the primate brain without impacting mitochondrial homeostasis.[J]. Protein & cell,2021,13(1).
[9]官建华. 早发型帕金森病基因多态性与临床表型研究[D].福建医科大学,2019.DOI:10.27020/d.cnki.gfjyu.2019.000664.
[10] Kin K, Yasuhara T, Kameda M, Date I. Animal Models for Parkinson's Disease Research: Trends in the 2000s. Int J Mol Sci. 2019;20(21):5402. Published 2019 Oct 30. doi:10.3390/ijms20215402
[11] Zeng XS, Geng WS, Jia JJ. Neurotoxin-Induced Animal Models of Parkinson Disease: Pathogenic Mechanism and Assessment. ASN Neuro. 2018 Jan-Dec;10:1759091418777438. doi: 10.1177/1759091418777438. PMID: 29809058; PMCID: PMC5977437.
[12] Chia SJ, Tan EK, Chao YX. Historical Perspective: Models of Parkinson's Disease. Int J Mol Sci. 2020 Apr 2;21(7):2464. doi: 10.3390/ijms21072464. PMID: 32252301; PMCID: PMC7177377.