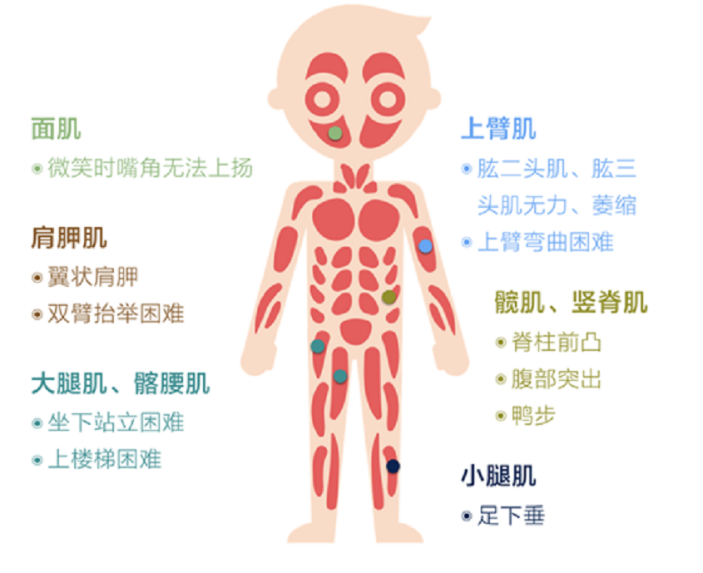
面肩肱型肌营养不良症——折翼的小飞侠
疾病概述
面肩肱型肌营养不良症(Facioscapulohumeral Muscular Dystrophy, FSHD)是进行性营养不良(porogressive muscular dystrophy) 的一种,是世界范围内位列第三的肌营养不良症,呈常染色体显性遗传。它的主要表现为面部、肩脾及上臂肌肉萎缩,并随着病程的发展逐渐向上臀、躯干肌和下肢肌肉进展,典型表现为在肩关节外展过程中肩脾骨上突,呈“翼状肩”,因此,也被称为“小飞侠病”。FSHD发病率约为1:20000至1:8000,在不同的年龄段,FSHD的症状表现程度各不相同。
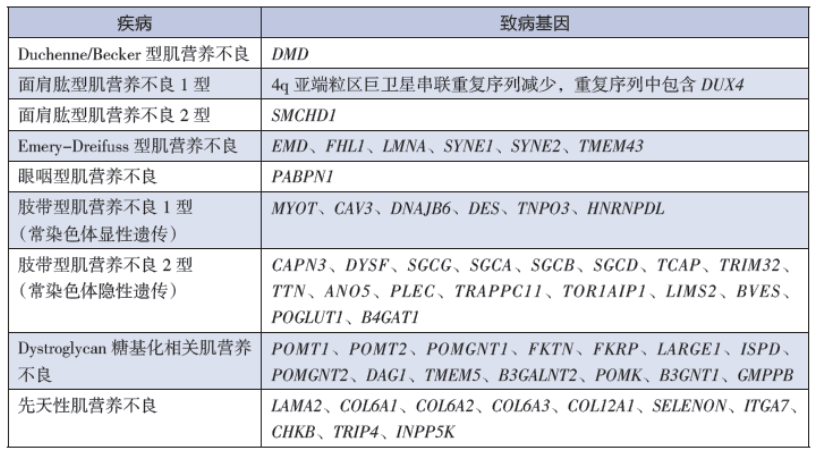
图1:进行性肌营养不良常见致病基因 来源:罕见病注册系统
致病基因
根据致病机理不同,临床上将FSHD分为两类,尽管其致病机制不同,但都会造成DUX4(Double homeo-box 4)基因在骨骼肌中异常表达或DUX4蛋白功能异常。
健康人的4号染色体长臂亚端粒区(4q35)上的等位基因D4Z4上有11-100个重复单元。占患者数量95%的FSHD1是由于D4Z4重复少于10,从而导致DUX4基因的甲基化程度降低以及抑制性异染色质的减少,染色质结构的开放允许D4Z4重复序列中的致病基因DUX4被转录而持续表达,DUX4的异常表达导致肌细胞调亡、氧化应激、干扰肌源性分化和诱导萎缩性肌管的形成,引起肌肉损伤。D4Z4重复数量越少则疾病越严重[1]。
图2:DUX4基因信息 来源:RDDC数据库
FSHD2占患者数量的5%,D4Z4重复数为8-20,未见明显的序列收缩。SMCHD1(Structural maintenance ofchromosomes flexible hinge domain containing 1)是可以维持D4Z4高甲基化和沉默状态的DNA甲基化调控基因,目前的研究表明FSHD2与SMCHD缺失密切相关。该基因突变导致其编码的蛋白质表达水平下降,从而使D4Z4区域DNA甲基化程度降低,在4gA等位基因(在D4Z4远端区域存在的等位序列)共同作用下,激活DUX4在骨骼肌中的表达而致病[2]。
图3:SMCHD1基因信息 来源:RDDC数据库
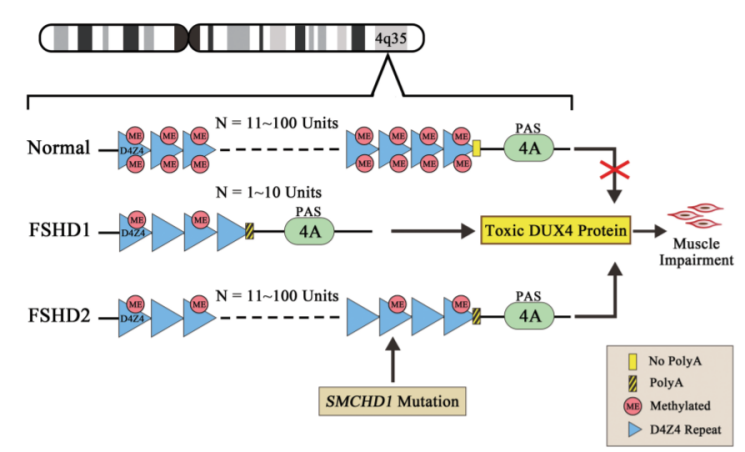
图4:FSHD的分子机制 来源:面肩肱型肌营养不良症的分子机制和治疗方法研究进展
临床症状
FSHD一般青少年起病,20岁外显率达95%,仅少数为婴幼儿早发型患者。FSHD病变主要累及面肌、肩脾带肌和上臂肌群,逐渐向下进展可累及躯干肌和下肢肌群,表现为不对称性肌无力和肌萎缩。除此还有非典型患者,例如骨骼肌系统外症状,神经性耳聋和视网膜毛细血管扩张,少数严重患者还会出现癫痛、智力障碍等[3,4]。FSHD的进展通常非常缓慢,并且很少影响心脏或呼吸系统,所以一般认为它不会危及生命,大部分患者都有正常的寿命。
图5 来源:云南省第一人民医院生殖医学科
动物模型
FLExDux4
FLExDux4 小鼠具有和FSHD患者相似的DUX4低甲基化水平,以及条件性、可滴定调节肌肉组织表型,是目前较为适合的肌营养不良症长期研究的模型[5]。
TIC-DUX4
TIC-DUX4小鼠也是研究DUX4致病性和疾病进展的理想模型,有学者证实,TIC-DUX4小鼠在分子、组织和功能水平上的表现都适合作为研究DUX4致病性和疾病进展相关的动物模型[6]。
DUX4 polyA
DUX4 polyA小鼠FSHD病程发展缓慢,展现出进行性肌病的特点,以及出现高频出现听力损失等FSHD相关症状[7]。
鉴别诊断
本病诊断主要以临床症状、体征为基础,肌活检组化染色虽具有一定的诊断价值,但缺乏与其他类型肌病相区别的特征性表现,因而难以与其他累及面肩脑肌群的肌病相鉴别。此外,临床上对于症状前患者及致病基因未外显的个体也无法作出诊断。因此,开展基因诊断,能够大大增加诊断的准确性,如应用双酶切/Southern杂交法、实时荧光定量聚合酶链反应法、 BioNano 光学图谱成像技术等基因检测方法诊断[8-10]。
治疗方法
FSHD至今尚无有效治疗手段,目前主要应用对症治疗,旨在通过被动活动和镇痛药给药预防关节僵硬和疼痛。在严重的情况下,可能需要呼吸机支持,手术治疗包括固定肩脾骨,可能改善手臂的运动范围。
图6:康复问题清单及康复策略 来源:江苏盛泽医院康复医学科
基因治疗研发进展
ARO-DUX4
ARO-DUX4是一款面肩肱型肌营养不良症(FSHD)潜在疗法, ARO-DUX4旨在选择性靶向和敲低DUX4,从而实现肌肉修复和肌肉功能的改善。美国Arrowhead公司2023年7月17日对外宣布,该公司已提交启动ARO-DUX4 1/2期临床试验的许可申请,Arrowhead公司将这项临床试验的申请已提交给了当地伦理委员会和新西兰药品和医疗器械安全局,供治疗试验常设委员会审查在等待批准之前,Arrowhead公司打算继续进行ARO DUX4-1001药物研究,这是一项1/2a期剂量递增研究,以评估ARO-DUX4在1型FSHD成年患者中的安全性、耐受性、药代动力学和药效学。该研究旨在招募最多52个临床研究受试者[11]。
ACE-083
ACE-083是由Acceleron制药研发的,一种基于体内天然产生的卵泡抑素(follistatin)蛋白质而开发的局部作用药物,利用“Myostatin+”方法来抑制多种TGF-β配体。该药被设计为在靶向肌肉内发挥聚集效应,选择性地最大化所治疗肌肉的生长和肌力。2018年,ACE-083获得FDA快速通道认定,遗憾的是,2019年,Acceleron公布,ACE-083治疗的面肩肱型肌营养不良症(FSHD)患者在2期试验中没有达到功能性次要终点。尽管ACE-083在平均总肌肉量(试验的主要终点)中表现出稳健的、统计学上显著的增加,但增加未能转化为功能测试的统计学显着改善。 因此,Acceleron将不会在FSHD中进行ACE-083的进一步临床试验[12]。
参考资料
[1] 石姗平,习阳.面肩肱型肌营养不良症的分子机制和治疗方法研究进展[J].生命的化学, 2020, 40(2):7.
[2] 林晓丹. 面肩肱型肌营养不良症表型-基因型4q35-D4Z4/PAS区域甲基化相关研究[D]. 福建:福建医科大学,2018.
[3] Padberg GW, Brouwer OF, de Keizer RJ,et al. On the significance of retinal vascular disease and hearing loss in facioscapulohumeral muscular dystrophy. Muscle Nerve Suppl,1995,(2):S73-80.
[4] van Deutekom JC, Wijmenga C, van Tienhoven EA, et al. FSHD associatedDNA rearrangements are due to deletions of integral copies of a 3.2 kb tandemlyrepeated unit. Hum Mol Genet, 1993, 2(12):2037-2042.
[5] 王丽莉.轮椅依赖型面肩肱型肌营养不良症患者的基因型-表型关系及DUX4-cre小鼠模型的初步研究[D].福建医科大学[2023-08-22].
[6] Giesige C R , Wallace L M , Heller K N ,et al. AAV-mediated follistatin gene therapy improves functional outcomes in the TIC-DUX4 mouse model of FSHD.JCI Insight, 2018, 3(22).
[7] Azzag K, Bosnakovski D, Tungtur S, et al. Transplantation of PSC-derived myogenic progenitors counteracts disease phenotypes in FSHD mice. NPJ Regen Med,2022 Sep 2,7(1):43.
[8] 王朝东,吴志英.应用双酶切/Southern杂交方法诊断面肩肱型肌营养不良[J].中华神经科杂志, 2002, 35(6):4.
[9] 苏全喜,李婉仪,张成,等.面肩肱型肌营养不良实时荧光定量PCR诊断方法的影响因素分析[J].军医进修学院学报, 2011, 32(7):748-751.
[10] https://www.grandomics.com/zdfw/ycbzd/fshd_bionano/
[11] http://fshd-china.org/page176.html?article_id=145
[12] https://www.vbdata.cn/newsDetail/d761ef2ad8c011e99ceb00163e0cb09b