结节性硬化症(TSC)——美丽却忧伤的疼痛“蝴蝶结症”
疾病概述
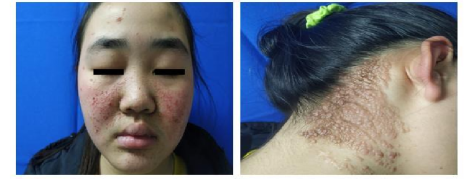
有这样一种罕见病,患者的面部会出现红褐色或与皮肤同色的小突起,以鼻子为中心,向鼻翼两边以蝴蝶形状长出,并对称散布在面部,就像是在脸上画出了一个蝴蝶结的图案。这种病有一个美丽的名字——蝴蝶结症,在医学上又称结节性硬化症。今年5月15日,是第11个“全球结节性硬化症关爱日”。该纪念日于2012年由美国结节性硬化症联盟(Tuberous Sclerosis Alliance)和世界各地的结节性硬化症患者组织、基金会、医生和研究人员等发起,以此呼吁全世界的人们携手共同关注结节性硬化症患者群体。
图1 蝴蝶结形状 图源来自网络
那么什么是结节性硬化症呢?
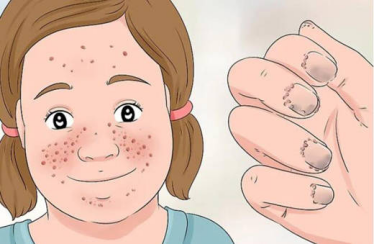
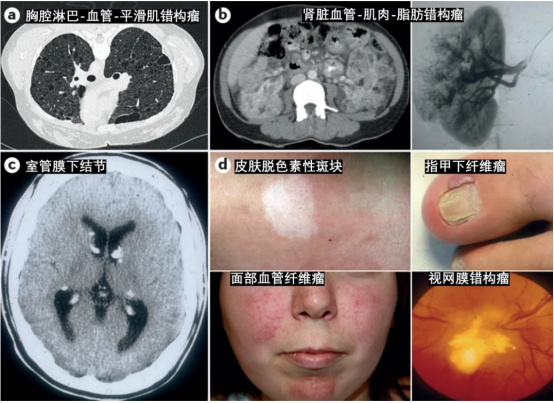
图2 结节性硬化症患者部分症状表现[3]
发病机制
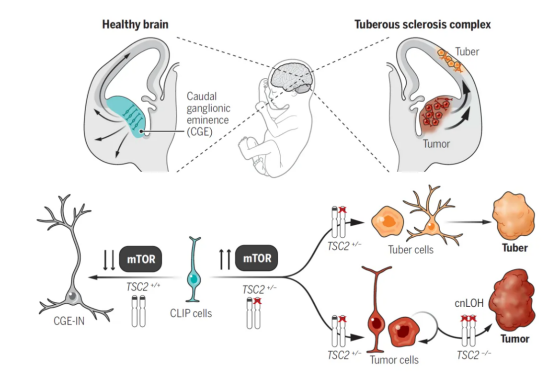
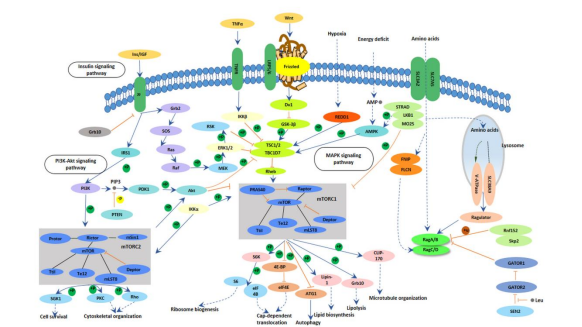
TSC的主要分子机制是肿瘤抑制基因TSC2失活突变,少数患者有TSC1失活突变。通常,TSC2基因突变患者的病情比TSC1基因突变患者重,基因突变的临床外显率几乎达到100%。部分患者检测不到TSC1或TSC2的突变。生理状态下,TSC肿瘤抑制基因TSC1和TSC2的蛋白质复合体抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),mTOR是一种丝/苏氨酸蛋白激酶。当TSC1或TSC2基因失活后,过度活化的mTOR促进细胞新陈代谢、细胞异常增生,导致TSC的发生。
TSC是伴有癫痫和自闭症的最常见遗传病。可发生在所有人种和民族,男性和女性的发病率无差异,每6000-10000名新生儿中有1名患有TSC。约2/3的TSC患者没有家族史,1/3患者的父母之一也罹患TSC。如果父母之一诊断为TSC,其子女患病概率是50%[4]。
图3 结节性硬化症发病机制[5]
结构特点
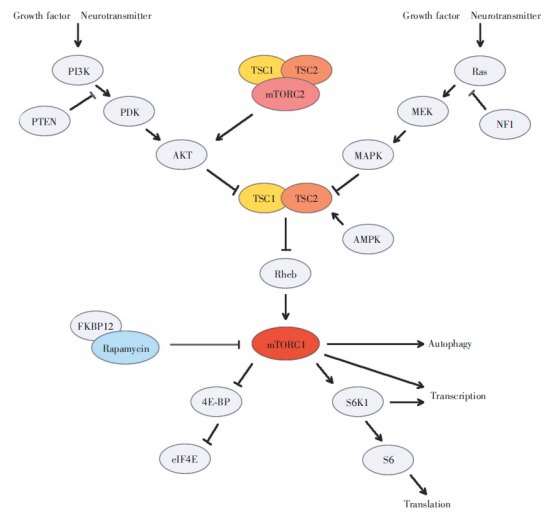
TSC1基因的位点在9号染色体长臂3区4带(9q34),TSC2基因位点在16号染色体短臂1区3带(16p13)。TSC1基因包含23个外显子,其转录产物为8.6kb的mRNA。将TSC1蛋白称为错构瘤蛋白(hamartin),该蛋白由1164个氨基酸组成,相对分子量为130kD。TSC2基因包含41个外显子,总长度为44kb,TSC2基因的表达产物称为马铃薯蛋白(tuberin),该蛋白相对分子质量为198kD,含有1807个氨基酸。Hamartin蛋白和Tuberin蛋白在高尔基体上形成异二聚体(heterodimer),即Tuberin-Hamartin复合物并共同发挥功能,该复合物具有GTP激活蛋白(GAP)作用,在PI3K/AKT信号转导通路和Ras/有丝分裂原激活蛋白激酶(MAPK)信号转导通路调控下,负向调节下游Rheb蛋白,抑制mTOR蛋白介导的信号转导,对细胞代谢、增殖和细胞骨架运动发挥重要调节作用,并有抗肿瘤作用(图3)。TSC基因突变导致mTOR信号转导通路异常激活,mTORC1蛋白活性增强,促进下游S6K1蛋白和4E-BP蛋白磷酸化,并负反馈抑制上游AKT蛋白激活,同时,TSC蛋白功能缺失亦抑制mTORC2蛋白介导的AKT蛋白激活,二者共同作用导致蛋白合成和细胞增殖增加,从而出现错构瘤等病理改变。TSC蛋白功能障碍对神经元生长和迁移、轴突形成、突触可塑性具有显著影响,可以造成相应神经系统症状;此外,mTOR信号转导通路亦与肥胖、2型糖尿病、神经退行性变和衰老等的发生与发展有关[2]。
图4 TSC蛋白与mTOR相关信号转导通路示意图[2]
临床表现
TSC常表现为多系统受累,其发生发展有一定的阶段性。在胎儿/新生儿期可以出现心脏横纹肌瘤,大部分可自发消退;出生后数月就可出现癫痫症状和皮肤症状;随着年龄的增大,出现肾血管平滑肌脂肪瘤和全身其他部位的肿瘤性病变;成年女性肺部容易出现肺部LAM(肺部淋巴管肌瘤病)。脑部病变主要包括脑皮质结节、室管膜下巨细胞星形细胞瘤和室管膜下结节等。皮肤病变包括出生后可见的白斑,逐渐生长的面部血管纤维瘤、鲨革斑、甲周纤维瘤及前额斑块等;高达90%的TSC患者有肾脏血管平滑肌脂肪瘤;约50%患者病变累及视网膜,但很少影响视力;约35%女性患者肺部出现LAM;其他如肝脏、胰腺、消化道、骨骼也可以受累,但一般症状较轻。
由于TSC患者的症状出现在多个学科,常在多个学科就诊,需要提高诊断意识,使患者避免误诊和漏诊;同时,多学科的合作对TSC患者的管理是非常重要的,TSC的核心受累器官包括神经系统、皮肤、肾脏和肺脏。
图5 结节性硬化症临床表现[5]
辅助检查
1.影像学检查TSC累及全身多个器官。特征性的影像表现包括:脑室管膜下结节(subependymalnodules,SEN)和室管膜下巨细胞星形细胞瘤(subependymalgiantcellastrocytoma,SEGA),脑皮层发育不良,心脏横纹肌瘤,肺淋巴管肌瘤病,肾血管平滑肌脂肪瘤等。
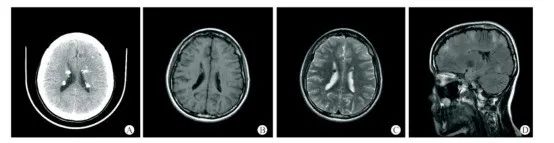
图6 19岁女性结节性硬化症患者的头颅CT+MRI平扫影像[6]
患者临床表现为癫痫及精神发育异常,右面部色素沉积斑、四肢及躯干多发色素脱失斑、双侧峡部皮脂腺瘤,胸椎多发斑片状致密影。A-C:头颅CT+MRI平扫示双侧室管膜下及皮层下多发结节样钙化灶;D:T2FLAIR示大脑半球皮层及皮层下多发异常高信号影。
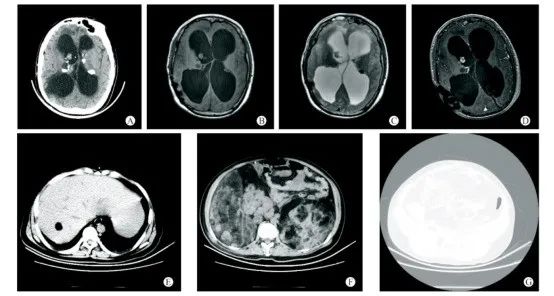
图7 19岁男性结节性硬化症患者的CT影像[6]
患者有癫痫并发育迟缓,9年前有双侧侧脑室室管膜瘤切除史。A-D:双侧室管膜下多发结节样钙化灶,右侧侧脑室内软组织结节;E:肝内错构瘤;F:双肾巨大错构瘤;G:椎体及双侧髂骨多发骨质硬化。
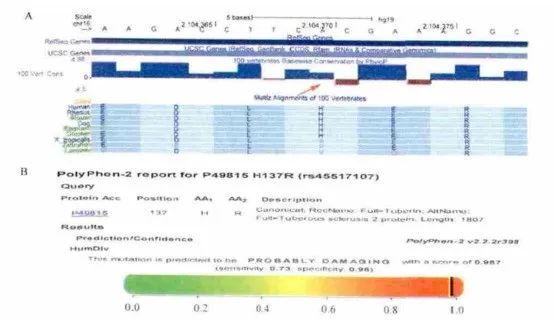
图8 对错义突变的生物信息学分析[7]
A: TSC2,c.410A >G 突 变 位 点 发 生 在 保 守 区 ( 红 色 箭 头 ) ;B: PolyPhen-2 软件预测此突变为极可能致病,相关预测分值为0.987.
临床诊断
1911年有学者总结该病的典型三联征为癫痫、智力低下和面部皮脂腺瘤。结节性硬化症(Tuberous Sclerosis Complex,TSC)基因产生突变的原因可能是由于其对环境敏感性增加。结节性硬化症诊断标准1998年,首届国际结节性硬化症共识大会修订诊断标准,该标准以临床诊断为主,迅速获得广泛认可和临床应用。2012年,第2届国际结节性硬化症共识大会再次修订诊断标准,增加基因诊断,并且指出基因诊断可以作为独立的诊断标准。
(1)基因诊断标准:
基因检测发现TSC1或TSC2基因致病性突变即明确诊断为结节性硬化症,其中,致病性突变系指明显降低TSC1或TSC2蛋白功能(如无义突变)、抑制蛋白合成(如大片段缺失),或经功能检测证实影响蛋白功能的错义突变;其他对功能影响不明确的TSC1或TSC2基因突变不能诊断结节性硬化症。有10%~25%的患者经常规基因检测未能检出基因突变,不能排除结节性硬化症的诊断,但与符合临床诊断标准的结节性硬化症不冲突。
(2)临床诊断标准:
①主要特征,包括色素脱失斑(≥3个,直径≥5mm);面部血管纤维瘤(≥3个)或头部纤维斑块;指(趾)甲纤维瘤(≥2个);“鲨鱼皮”样斑;多发性视网膜错构瘤;脑皮质发育不良(包括皮质结节和白质放射状移行线);室管膜下结节;室管膜下巨细胞型星形细胞瘤(SEGA);心脏横纹肌瘤;肺淋巴管肌瘤病;肾血管平滑肌脂肪瘤(≥2处)。
②次要特征,包括“五彩纸屑样”样皮肤损害;牙釉质点状凹陷(>3个);口内纤维瘤(≥2个);视网膜色素脱色斑;多发性骨囊肿;非肾脏错构瘤;视网膜无色性斑块;脑白质“移行痕”(在T2WI和T2FLAIR序列上表现为由深部脑白质延伸至皮质的细长边界清晰的线条状高信号);直肠息肉;骨囊性变。
具备2项主要特征,或者具备1项主要特征和2项次要特征,诊断为确定的(definite)结节性硬化症;具备1项主要特征,或2项次要特征,诊断为疑诊(possible)的结节性硬化症;仅肺淋巴管肌瘤病和肾血管平滑肌脂肪瘤作为主要特征同时存在,还需要其他特征方诊断为结节性硬化症[4]。
图9 结节性硬化症部分特征[8]
动物模型
为了进一步对TSC进行研究,科学家们开发了一系列大小鼠模型,其中包括:
1.Eker大鼠模型
Eker大鼠模型携带Tsc2肿瘤抑制基因上的一个缺陷,TSC2单拷贝基因缺失的雌性Eker大鼠(TSC2EK/+),由于TSC2表达产物马铃薯球蛋白的表达缺失,从而出现mTOR信号通路激活。
2.Tsc2基因缺失细胞注射小鼠模型
传统的纯合子TSC2敲除小鼠会出现神经系统及心脏畸形,在胚胎期死亡;而杂合子TSC2敲除小鼠虽然可以存活,却无法形成肺部病变。2012年,有学者将Tsc2缺失细胞注射入免疫缺陷型裸鼠体内,观察到小鼠出现TSC2缺失样肺部改变,但是该建模方法病变产生的病理机制上并不符合疾病本身,非自发形成。
3.TSC1基因突变小鼠模型
TSC1敲减和敲除小鼠模型表型非常相似,且TSC1敲减模型与TSC2敲减模型表型也很相似,这种动物模型被认为是TSC1/2复合体调控mTORC1通路的第一手体内研究证据。可惜的是,C57BL/6小鼠系(非C3H或Balb/c小鼠系)约25%的杂合子TSC1小鼠幼崽在出生后断奶前不明原因死亡,无法进行进一步的研究。
4.组织特异性TSC2或TSC1基因敲除小鼠模型
已有研究尝试将TSC1或TSC2条件性等位基因小鼠与组织特异性cre等位基因小鼠杂交,组织病理却未能发现肾脏或肺部的病变,且这类小鼠常在出生后不久出现不明原因死亡。特定的基因敲除时间点及基因所在细胞位置是该类建模的关键,仍需进一步摸索,这类可自发形成病变的模型对于疾病的理解意义更为深远[9]。
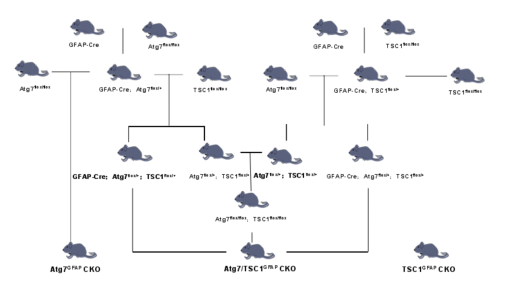
5.Atg7/TSC1GFAPCKO双基因敲除小鼠
有学者通过繁殖培育出Atg7/TSC1GFAPCKO双基因敲除小鼠[10],具体培育方式如下图:
图10 基因敲除小鼠培育方案简图[10]
治疗方式
目前研究证实TSC的致病基因是TSC1、TSC2,但从目前有限的文献中发现,TSC2基因的神经系统病灶较TSC1更广泛、癫痫发生率更高,肾脏、肺部、眼部、面部的相关疾病患病率更高。在治疗方面,目前多为对症支持治疗[2]。
1.药物治疗:mTOR抑制剂——雷帕霉素(RAPA)
RAPA是一种哺乳动物RAPA靶蛋白(mammalian target of rapamycin mTOR)抑制剂,由于TSC和TSC蛋白参与调节mTOR激酶活性,当TSC1或TSC2发生突变mTOR激酶活性异常增加导致TSC,因此考虑应用RAPA治疗TSC。RAPA因抑制mTOR活性参与调节细胞生长亦可用于抗真菌治疗,在器官移植术后也作为免疫调节药物应用,其通过抑制白细胞介素-2从而阻碍激活T淋巴细胞及B淋巴细胞来抑制免疫。RAPA通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其他细胞由G1期至S期的进程,从而发挥免疫抑制效应。研究显示,RAPA可缩小室管膜下巨细胞星型细胞瘤(subependymal giant cell astrocytomas,SEGA)、肾血管平滑肌脂肪瘤或肺淋巴管肌瘤病的肿瘤体积,可用于治疗TSC。依维莫司能够缩小SECA,在一些TSC病例中,其可作为外科手术之外的另外一种选择。
图11 mTOR 信号通路[11]
2.婴儿痉挛症的治疗
婴儿痉挛症的治疗推荐个体化用药方案,氨己烯酸是治疗TSC合并婴儿痉挛症的一线药物。氨己烯酸是一种GABA转氨酶抑制剂,可引起抑制性神经递质GABA水平增加,目前已被证明治疗TSC合并婴儿痉挛症很有效。其他传统的抗癫痫药物(AEDs),包括苯巴比妥、苯二氮䓬类药物、丙戊酸和托吡酯,疗效则不明显或完全无效。卡马西平、奥卡西平和苯妥英可能导致癫痫发作的恶化,特别是在年幼的儿童和婴儿,这些药物可以加重婴儿痉挛,故不推荐应用于TSC合并婴儿痉挛的治疗。其他治疗,如肌肉注射促肾上腺皮质激素(ACTH)或口服糖皮质激素,可作为二线治疗,但疗效较氨己烯酸欠佳。
3.外科治疗
一但确诊SEGA,只要患者无临床症状,且被判断无急性脑积水的危险,临床医师可以选择继续影像学检査动态随访,否则,将釆取手术切除病灶,这是目前治疗SEGA的一种明确方案。局灶皮层结节切除对于大多数TSC患者属于姑息性而非治愈性手术;胼胝体切断可以有效减少失张力和强直发作,但对其他发作效差。少数患者胼胝体切断术后可达到癫痫无发作;SEGAs产生脑积水或明显占位效应时应手术切除,但可能复发。
4.迷走神经刺激(VNS)
VNS可以明显减少TSC患者简单部分性和复杂部分性发作,可以用于儿童癫痫的治疗,也可以改善成人癫痫中的情绪改变。关于VNS疗法目前证据尚不足,但是相关实验数据均表明,单用此种疗法,几乎没有患儿可免除癫痫发作。这种疗法可以和生酮饮食联合进行,尤其对那些耐药且不适宜手术治疗的患者。
5.生酮饮食
生酮饮食是一个由2:1,3:1,4:1,或更高比例的脂肪含量的蛋白质和碳水化合物(抗生酮的食物)。生酮饮食应用于治疗难治性癫痫已有超过80年的历史,其有效性和安全性已得到国际公认。其作用机制有4条途径,减少碳水化合物生成、活化三磷酸腺苷(ATP)、抑制哺乳动物RAPA通路,抑制谷氨酸兴奋性突触传递[12]。
声明:本文收集归纳的信息,如有错漏,欢迎批评指正!
参考文献及图片来源:
[1]https://www.nrdrs.org.cn/app/rare/disease-list-article.html?index=114
[2]邓劼,王旭.结节性硬化症遗传学研究及诊断与治疗进展[J].中国现代神经疾病杂志,2018,18(06):385-390.
[3]https://www.sohu.com/a/545473406_100023056
[4]陈诗琪,肖新兰.结节性硬化症基因表型与其临床表现、影像学特征相关性研究[J].临床放射学杂志,2021,40(11):2210-2214.DOI:10.13437/j.cnki.jcr.2021.11.035.
[5]https://zhuanlan.zhihu.com/p/482638235
[6]刘朵朵,仲津漫,李晓会,杨全新.结节性硬化症的临床特征及影像学诊断[J].西安交通大学学报(医学版),2021,42(03):433-437.
[7]黄昌艳.结节性硬化症TSC1/TSC2基因突变的高通量测序快速诊断[J].细胞与分子免疫学杂志,2016,32(01):92-95.DOI:10.13423/j.cnki.cjcmi.007631.
[8]洪佳琦. 结节性硬化症的基因突变检测及临床分析[D].安徽医科大学,2020.DOI:10.26921/d.cnki.ganyu.2020.000130.
[9]任思颖,胡衍,欧阳若芸,陈平.结节性硬化症与淋巴管平滑肌瘤病的动物模型研究进展[J].中华结核和呼吸杂志,2016,39(12):977-979.
[10]董淑敏. 敲除Atg7对结节性硬化症小鼠的作用[D].浙江大学,2021.DOI:10.27461/d.cnki.gzjdx.2021.002440.
[11]https://mbd.baidu.com/newspage/data/dtlandingwise?nid=dt_4254593792612082618&sourceFrom=homepage
[12]焦富勇,卫丽,王杰民,王亚东.小儿结节性硬化症治疗进展[J].中华实用儿科临床杂志,2014,29(09):710-712.