Nature子刊丨双靶向SORT LNP技术,攻克AATD多器官递送难题
α1-抗胰蛋白酶缺乏症(AATD)是一种由SERPINA1基因中的PiZ突变引发的遗传性疾病。该突变导致肝脏中错误折叠的α1-抗胰蛋白酶(A1AT)蛋白积累,进而引发肝损伤,如肝炎或肝硬化。同时,A1AT在肺部的缺乏使得中性粒细胞弹性蛋白酶(neutrophil elastase)活性失控,导致蛋白水解损伤和肺气肿。AATD是一种多器官受累的疾病,其在肝脏表现为毒性获得性功能(toxic gain-of-function),而在肺部则表现为毒性丧失性功能(toxic loss-of-function)。
目前,AATD的治疗面临挑战,尤其是在多器官(肝脏和肺部)中实现有效基因编辑的递送系统尚不存在。基因编辑技术,尤其是碱基编辑(base editing),为纠正SERPINA1基因中的PiZ突变提供了潜在的治疗方法。然而,AATD的多器官特性导致基因编辑工具向多个受影响组织的有效递送面临复杂挑战。
脂质纳米颗粒(LNPs)是目前最先进的RNA治疗药物递送系统,已被用于递送小干扰RNA(siRNA)、信使RNA(mRNA)和基因组编辑器。德克萨斯大学西南医学中心Daniel J. Siegwart团队开发了双重选择性器官靶向脂质纳米颗粒(Dual SORT LNPs),用于将碱基编辑器递送到肝脏和肺部。通过优化LNPs的配方,作者在小鼠模型中验证了Dual SORT LNPs的递送效率和基因编辑效果,包括对肝脏和肺部特定细胞类型的编辑效率,以及对A1AT蛋白水平和中性粒细胞弹性蛋白酶活性的影响。相关内容以“Dual SORT LNPs for multi-organ base editing”为题发表在《Nature Biotechnology》上。

【主要内容】
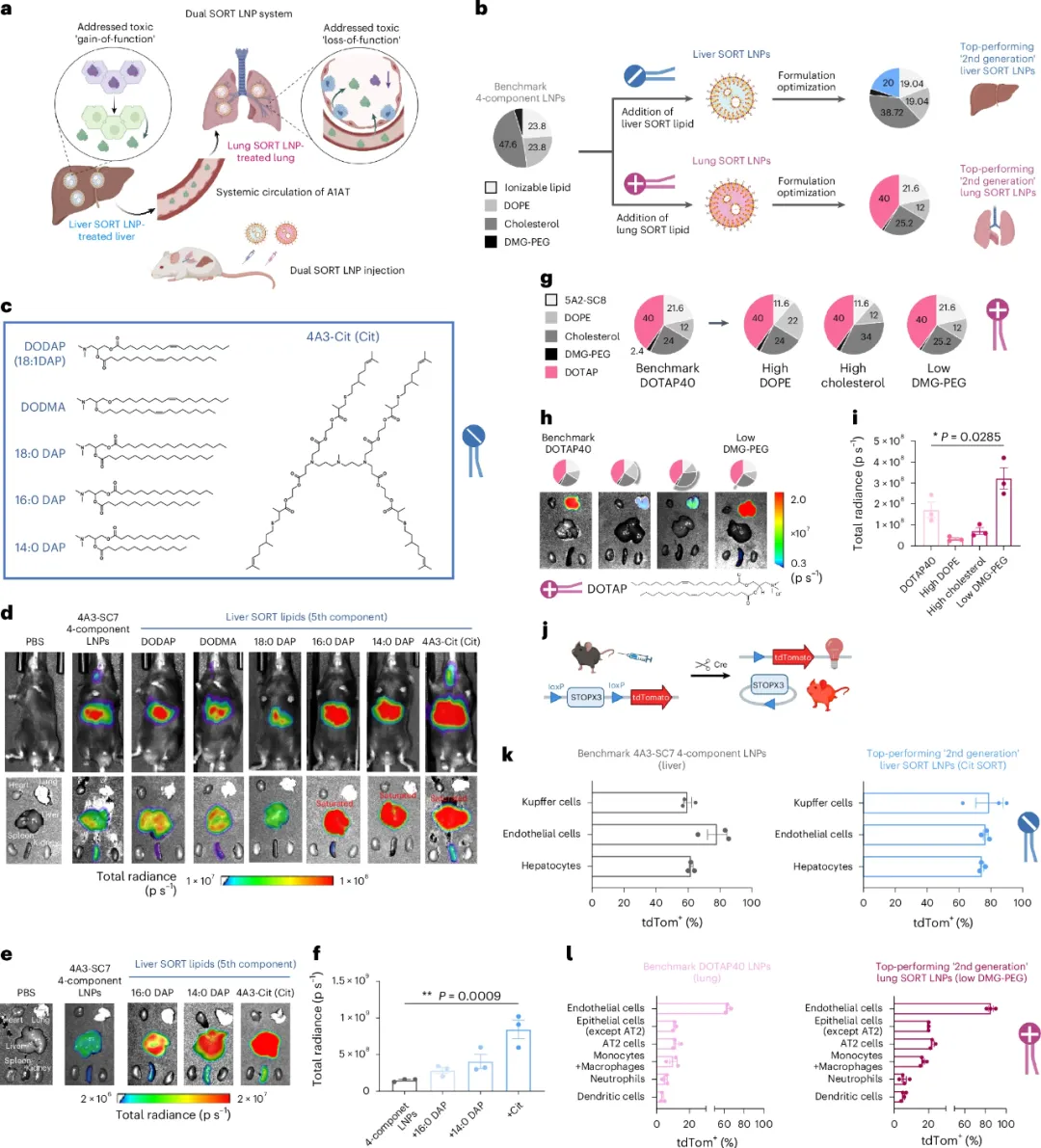
图1 Dual SORT LNPs的设计与优化
研究人员开发了这种双重选择性器官靶向脂质纳米颗粒(Dual SORT LNPs),用于将碱基编辑器递送到肝脏和肺部。通过在传统4组分LNPs中加入第五种SORT脂质,研究人员能够实现对特定器官的靶向递送。图中详细描述了如何通过调整脂质的组成和比例来优化LNPs的配方,以提高其在肝脏和肺部的递送效率。实验结果表明,优化后的Liver SORT LNPs能够高效转染约90%的肝细胞,而Lung SORT LNPs能够转染约20%的支气管上皮细胞和约17%的肺部单核细胞及巨噬细胞。
研究人员评估了多种ABE变体和单导向RNA(sgRNA)的组合,发现ABE8e-NGC和19-nt sgSERPINA1的组合在体外实验中表现出了最高的编辑效率。此外,研究人员还对Liver SORT LNPs进行了重新设计,以实现对较长ABE mRNA的高效封装。通过调整脂质与RNA的比例以及SORT脂质的含量,研究人员成功开发出了能够同时封装ABE mRNA和sgRNA的全合一LNPs。实验结果表明,这种优化后的LNPs在体外实验中实现了高达40%的校正编辑效率,并且没有检测到非目标位点的编辑。
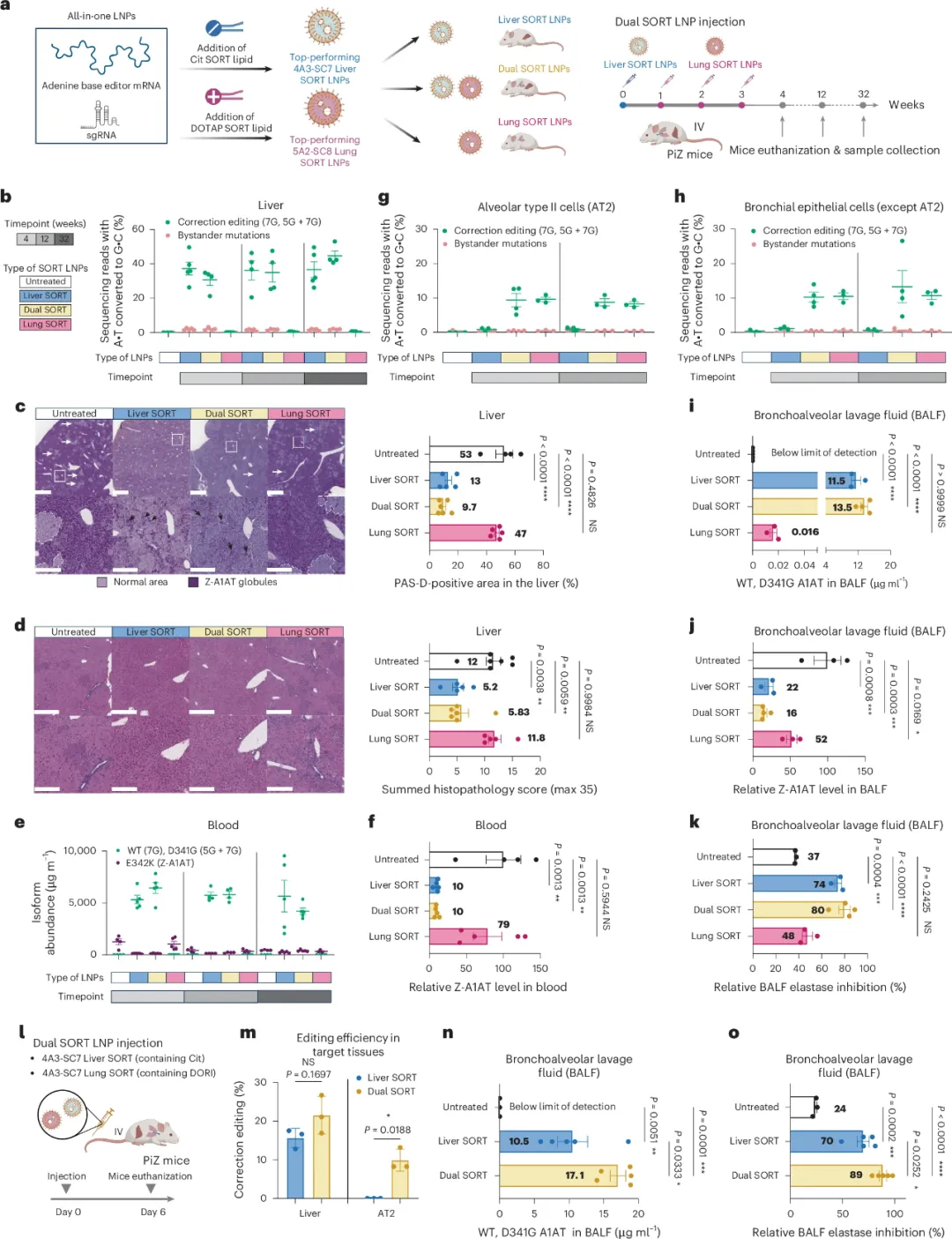
图2 Dual SORT LNPs在PiZ小鼠模型中的体内编辑效果
研究人员通过静脉注射Dual SORT LNPs,包括Liver SORT LNPs和Lung SORT LNPs,来纠正小鼠肝脏和肺部的SERPINA1基因突变。实验结果显示,Liver SORT LNPs在肝脏中实现了高达40%的校正编辑效率,并且这种编辑效果在32周内保持稳定。此外,研究人员还通过组织学检查确认了Dual SORT LNPs在减少Z-A1AT蛋白聚集和改善肝脏病理方面的效果。在肺部,Lung SORT LNPs实现了约10%的校正编辑效率,并且在支气管肺泡灌洗液(BALF)中检测到了功能性人类A1AT蛋白,这表明肺部编辑有助于恢复局部A1AT水平,从而抑制中性粒细胞弹性蛋白酶的活性。
【全文总结】
Dual SORT LNPs为AATD等多器官疾病的长期基因组纠正提供了一种有前景的治疗方法。该系统能够同时纠正肝脏和肺部的SERPINA1基因突变,减少Z-A1AT蛋白的积累,并恢复功能性A1AT蛋白的表达,从而抑制中性粒细胞弹性蛋白酶的活性。此外,Dual SORT LNPs在小鼠模型中显示出良好的安全性和耐受性,没有引起明显的器官毒性。这些发现强调了创新递送策略在推进基因编辑治疗复杂遗传性疾病中的重要性,并为未来的临床应用提供了科学依据。
原文链接:https://doi.org/10.1038/s41587-025-02675-z