AAV精准靶向胰腺组织:血清型、启动子、注射方式全总结
发布时间: 2025-02-05
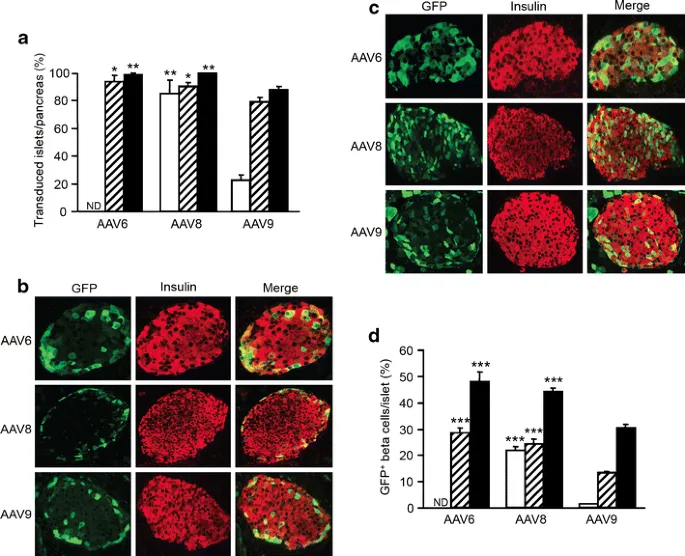
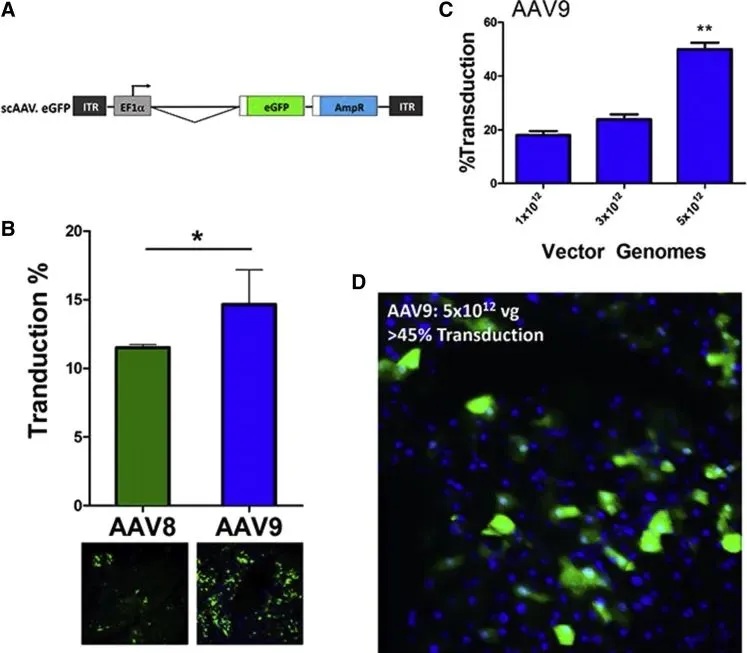
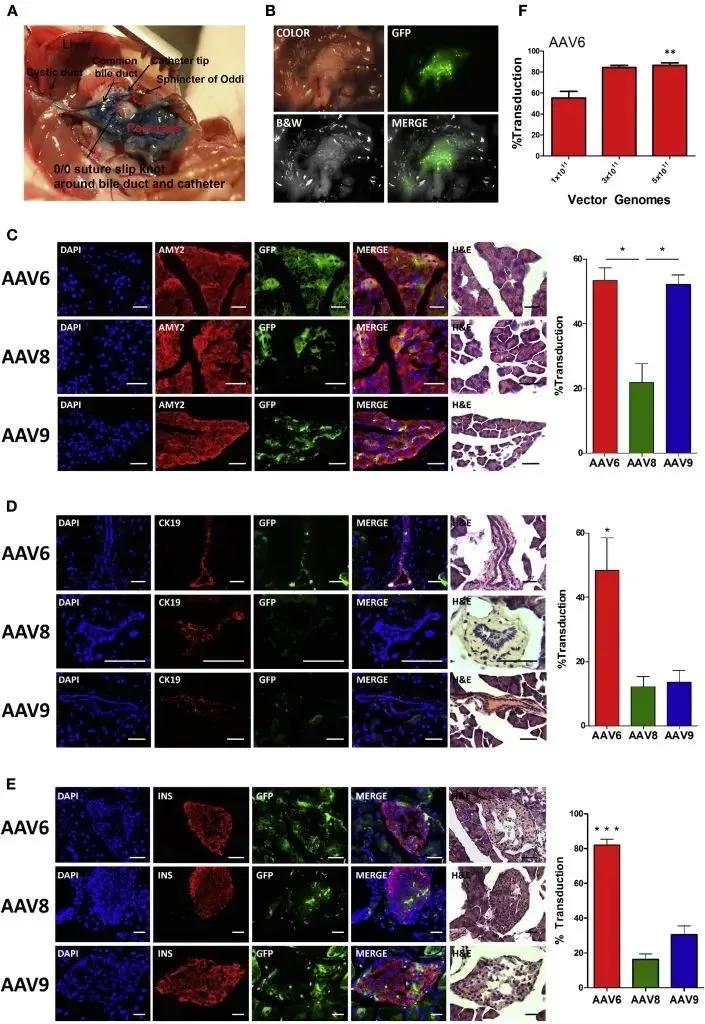
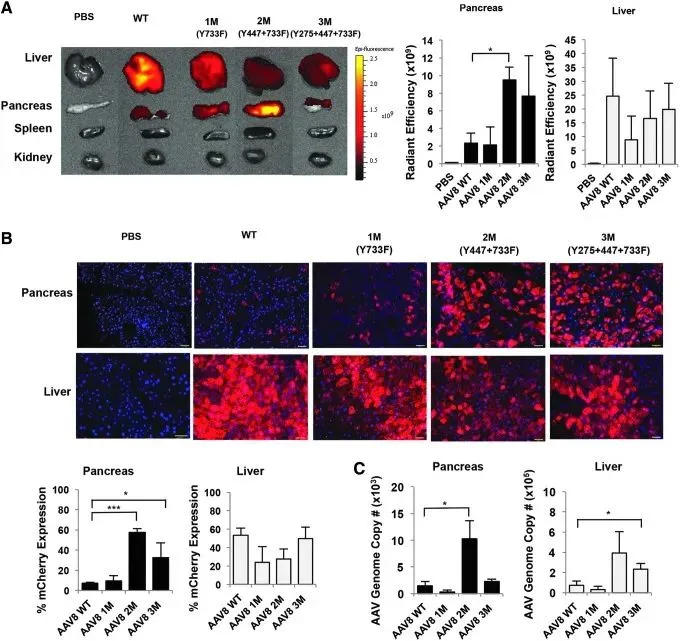


在Wang J [6]等人研究中,研究人员通过腺相关病毒载体(AAV8-RIP2-Nr3c1-3×Flag)将NR3C1基因导入小鼠胰腺,从而利用RIP2启动子在β细胞中特异性过表达NR3C1。这种β细胞特异性的NR3C1过表达小鼠模型可用于研究NR3C1在糖尿病发病机制中的作用。


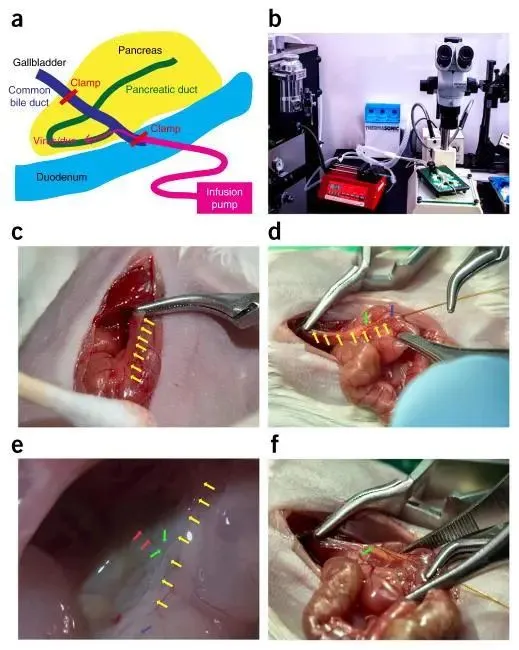
来源:OriCell细胞生物学
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。