文献分享 | 利用ABE介导的基因编辑疗法,长期恢复隐性基因突变耳聋小鼠听力
遗传性耳聋是一种常见的由遗传因素引起的感觉障碍。全球约有2600万人受先天性耳聋影响,其中遗传因素约占病例的60%。
听神经病谱系障碍(Auditory neuropathy spectrum disorder,ANSD)是一种常见的常染色体非综合征型听力损失,其特征是听觉信号从耳蜗经听神经传入大脑的突触编码和/或神经传播受损。OTOF是第一个被发现的影响ANSD的基因,其编码耳畸蛋白(Otoferlin),与41%-91%的ANSD病例有关。此外,OTOF基因突变占遗传性耳聋病例的2%-8%。
OTOF基因的c.2485C>T(p.Q829X)突变是OTOF突变致耳聋的高加索人群中最常见的隐性致病突变,携带纯合子OTOF p.Q829X突变的患者通常表现为语前发病的严重、双侧和对称感音神经性听力损失。
遗憾的是,目前还没有可用于治疗这种严重的听力损失的药物上市,几项针对OTOF突变所致耳聋的早期临床试验显示出了良好的治疗效果,但这些治疗方法的长期疗效和安全性仍有待全面阐明。
2024年8月12日,复旦大学附属眼耳鼻喉科医院舒易来教授团队在 Nature Biomedical Engineering期刊发表了题为:A base editor for the long-term restoration of auditory function in mice with recessive profound deafness的研究论文。
该研究利用腺嘌呤碱基编辑器(ABE)介导的基因编辑疗法有效修复了耳聋小鼠模型的Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。据悉,这是耳聋基因治疗领域,在动物模型中迄今观察时间最长的有效结果。

近年来,碱基编辑器(base editor)在高胆固醇血症、苯丙酮尿症、酪氨酸血症、早衰症、杜氏肌营养不良、Leber氏先天性黑蒙症、镰状细胞病及β-地中海贫血等多种遗传病的治疗中显示出巨大潜力。
值得注意的是,碱基编辑疗法已开始进入早期临床试验,用于治疗PCSK9基因突变引起的杂合子家族性高胆固醇血症,以及治疗急性淋巴细胞白血病。
碱基编辑器,例如腺嘌呤碱基编辑器(ABE)和胞嘧啶碱基编辑器(CBE),它们分别可以精确地将A·T转换为G·C,将C·G转换为T·A,而不会引起DNA双链断裂,被认为比基于CRISPR-Cas9的基因编辑技术更安全。
2020年6月,碱基编辑技术开创者刘如谦教授等人在Science Translational Medicine期刊发表论文【2】,通过双AAV载体递送胞嘧啶碱基编辑器(CBE),部分恢复了Tmc1基因隐性突变导致的完全耳聋小鼠的听力。这是人类首次通过基因编辑技术解决隐性遗传突变导致的遗传疾病,但治疗的小鼠只有部分听力恢复,并且这一效果在6周内减弱。这强调了在临床转化中进一步优化长期治疗疗效的必要性。
在这项最新研究中,研究团队评估了6种优化的腺嘌呤碱基编辑器(ABE)及sgRNA对Otof c.2482C>T(p.Q828X)从无义突变的A·T突变修复为野生型的G·C碱基对的效率。然后,研究团队将其中最有希望的ABE(由脱氨酶ABE7.10max和Cas9变体SpCas9-NG组成)-sgRNA组合包装到双载体腺相关病毒(AAV)血清型PHP.eB中(该AAV血清型对毛细胞转导效率高),并通过内耳注射给出生后1-3天的OtofQ828X/Q828X小鼠模型。
结果显示,这种ABE介导的基因编辑疗法有效修复了Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。
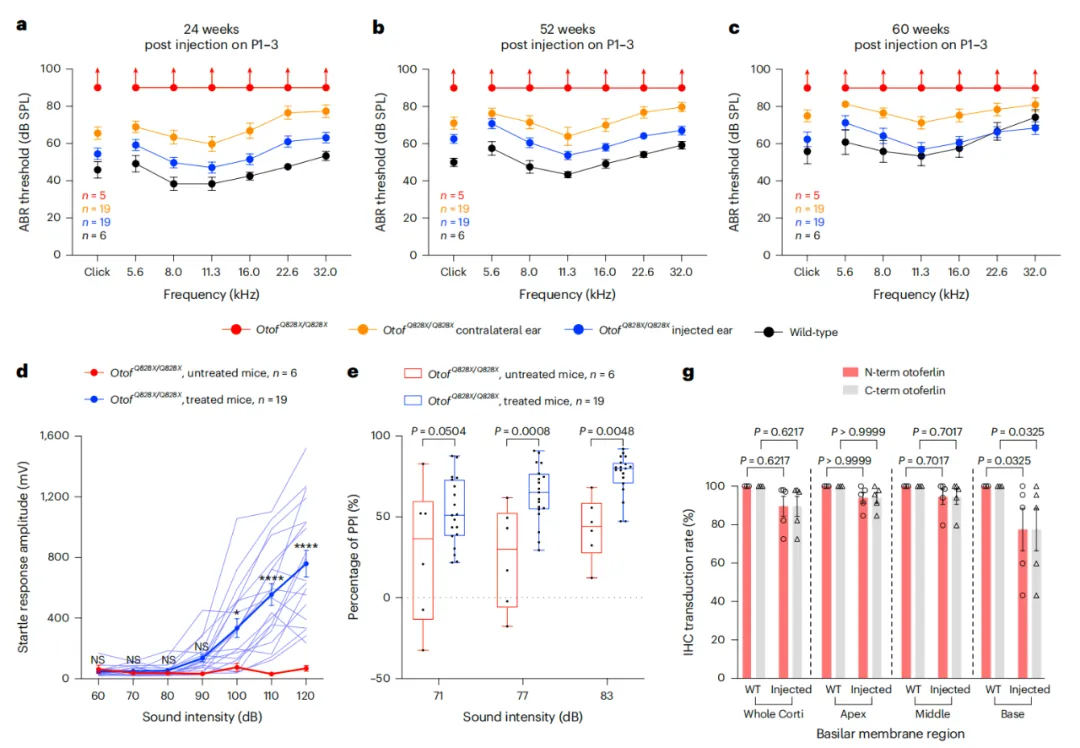
此外,即使给出生13-14天的OtofQ828X/Q828X小鼠模型治疗,它们的听觉功能也能得到显著恢复。研究团队还开发了针对人OTOF c.2485C>T(p.Q829X)位点的ABE治疗策略,将人源化OtofQ829X/Q829X小鼠模型的听力恢复到了与野生型小鼠相当的水平。
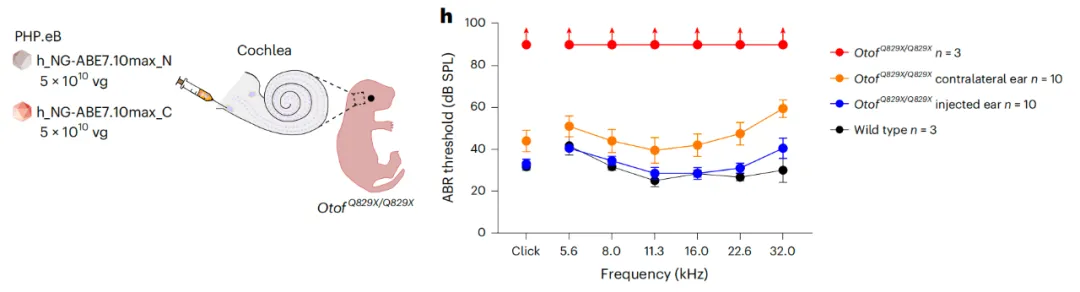
这些发现提示,腺嘌呤碱基编辑器(ABE)可用于挽救听觉突触病病例的听力功能,从而为遗传性听力损失提供了潜在的精准治疗策略。
Nature Biomedical Engineering 期刊同期还发表了News & Views文章,介绍了这项使用碱基编辑器纠正耳聋基因突变的新进展。

值得一提的是,2024年1月25日,复旦大学附属眼耳鼻喉科医院舒易来、李华伟、王武庆团队联合哈佛大学医学院及东南大学的研究人员在国际顶尖医学期刊《柳叶刀》(The Lancet)上发表了题为:AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial的研究论文【3】。

这项在6名因OTOF双等位基因突变而听力严重障碍的患儿中进行的临床试验结果显示,AAV1-hOTOF作为一种常染色体隐性遗传性耳聋的新型基因疗法,具有良好的安全性和有效性。6名接受治疗的患儿中有5人获得了稳健的听力恢复和语言感知能力的改善。这些结果支持在常染色体隐性耳聋患儿中进行进一步的基因治疗研究。
据悉,这是迄今为止治疗患者最多、随访时间最长的基因疗法治疗遗传性耳聋的人体临床试验,也是全球第一项获得临床疗效的内耳基因治疗和双AAV载体的人体试验(Frist in Human)。
来源:生物世界
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。