文献分享 | 张锋等团队合作揭秘Prime Editor精准基因编辑机制

CRISPR RNA引导的内切酶Cas9结合单向导RNA (sgRNA)并切割与向导RNA互补的双链DNA (dsDNA)靶标。因此,基于CRISPR-Cas9的方法已被用于真核细胞的基因组编辑。一种通用的基因组编辑方法——先导编辑——已经被开发出来,它允许几乎任何所需的碱基替换、小插入或小删除被安装到基因组的特定位置,而不需要双链断裂或供体DNA模板。因此,先导编辑可以潜在地纠正绝大多数已知的致病突变。事实上,先导编辑已经被广泛应用于在人类细胞和各种生物(如植物、斑马鱼、老鼠和果蝇)中植入精确的突变。
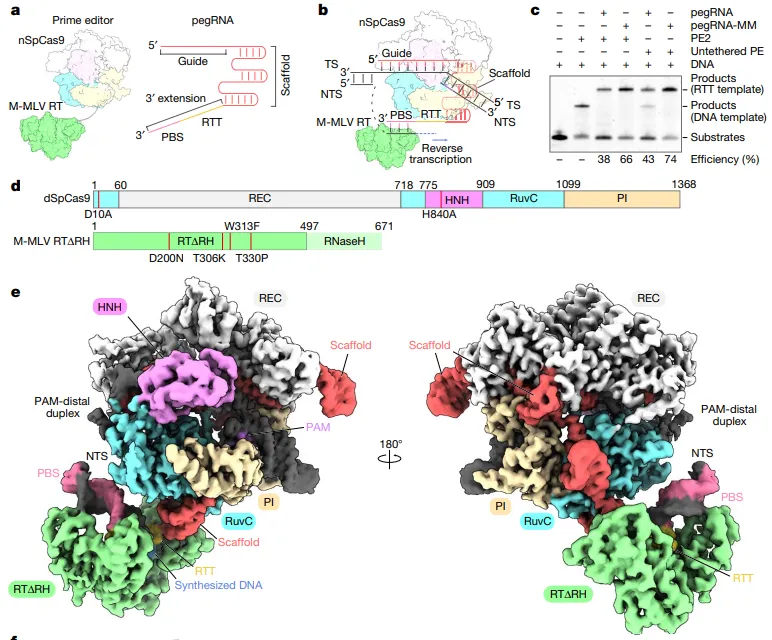
先导编辑系统有两个组成部分:一个由化脓性链球菌Cas9酶(nSpCas9)和工程Moloney小鼠白血病病毒逆转录酶(M-MLV RT)组成的先导编辑器;以及具有sgRNA区和3 '延伸区的先导编辑引导RNA (pegRNA)。sgRNA区域由靶向特定位点的引导序列和与SpCas9相互作用的支架组成,而3 '扩展区域包括逆转录模板(RTT)和引物结合位点(PBS)。
终端状态下的先导编辑器的Cryo-EM结构(图源自Nature )
PBS具有10-15个核苷酸(nt)序列,与非靶链(NTS)的3 '端互补,RTT编码所需的编辑。在先导编辑中,nSpCas9识别与sgRNA引导片段互补的dsDNA靶标序列,并识别NGG(其中N为任意核苷酸)相邻原间隔基序(PAM),并切割NTS。然后,M-MLV RT与PBS-NTS杂化双链(heteroduplex)结合,并对RTT序列进行逆转录,将所需的编辑整合到目标位点中。
然而,主要由于缺乏结构信息,先导编辑器识别PBS-NTS杂化双链(heteroduplex)启动和终止RTT序列逆转录的机制仍然知之甚少。为了解决这个问题,该永久在多种状态下测定了先导编辑器的冷冻电镜(cryo-EM)结构,为理解这一创新的基因组工程系统提供了一个结构框架。
来源:iNature
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。