Nature Biotechnology:诺奖获得者又一力作!Doudna团队开发新的方法,可以将基因组编辑工具递送到特定细胞
病毒和病毒衍生的颗粒具有向细胞递送分子的内在能力,但容易改变细胞类型选择性的困难阻碍了它们用于治疗递送。
2024年1月14日,加州大学伯克利分校Jennifer A. Doudna团队在Nature Biotechnology 在线发表题为“In vivo human T cell engineering with enveloped delivery vehicles”的研究论文,该研究证明了通过包裹CRISPR-Cas9蛋白和引导RNA的膜源性颗粒上显示的抗体片段识别细胞表面标记物,可以将基因组编辑工具递送到特定细胞。
与依赖进化的衣壳趋向性递送病毒编码货物的腺相关病毒等传统载体相比,这些Cas9包装包膜递送载体(Cas9-EDVs)利用可预测的抗体-抗原相互作用,选择性地将基因组编辑机制短暂地递送到感兴趣的细胞。抗体靶向的Cas9-EDVs在体外和体内混合群体中优先赋予同源靶细胞基因组编辑功能,而不是旁观者细胞。通过使用多重靶向分子直接递送到人类T细胞,Cas9-EDVs能够在人源化小鼠中产生基因组编辑的嵌合抗原受体T细胞,建立了一种具有广泛治疗用途潜力的可编程递送方式。

图1 来源:Nature Biotechnology官网
涉及基因组编辑的治疗干预需要安全有效地将分子输送到目标细胞核中。尽管这种能力将改变临床和研究应用,但目前的非病毒递送仅限于体外处理的细胞,局部给药的组织或肝脏,因为其天然的分子摄取倾向。最近的脂质纳米颗粒制剂已被描述为对非肝细胞或器官具有亲和性,但体内基因组编辑应用的扩展可能需要多种方法,以便在系统给药后将分子递送到体内的特定细胞或器官。
重定向病毒或病毒载体的趋向性是一种既定的递送策略,涉及细胞选择性靶向分子的表面展示,以及通过在质膜或内体的低pH环境中融合进入细胞所需的病毒糖蛋白。最近的进展利用了水泡性口炎病毒糖蛋白(VSVG)的突变形式,VSVGmut,维持内体融合活性,但缺乏天然低密度脂蛋白受体结合亲和力。将VSVGmut与细胞特异性靶向分子配对可以重定向慢病毒的转基因递送,并且可以高通量筛选T细胞和B细胞受体文库以研究受体-抗原相互作用。
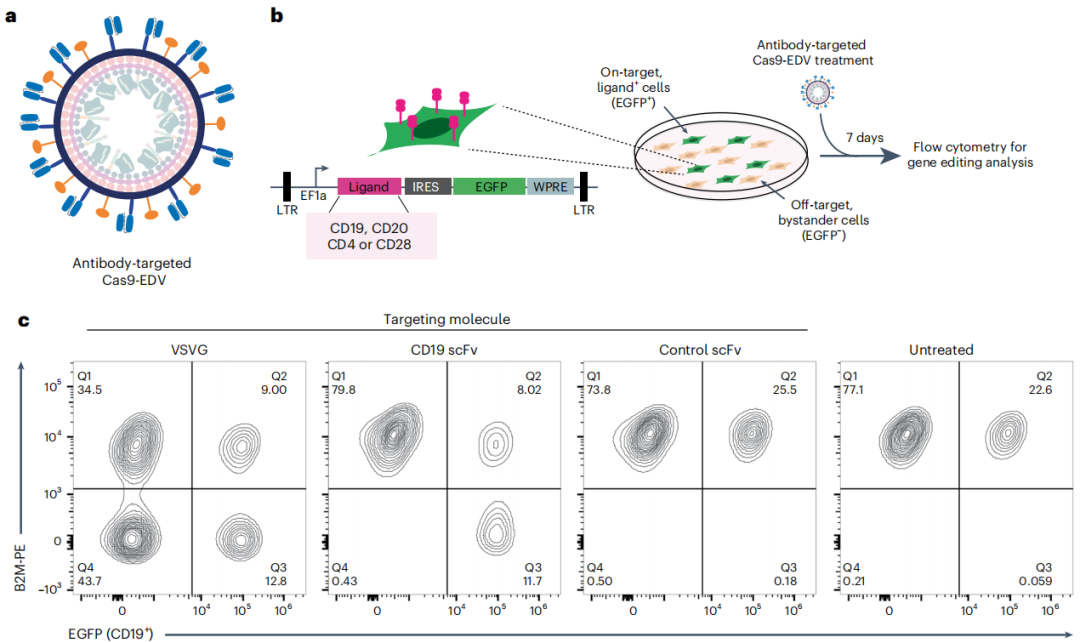
图2:利用抗体靶向Cas9-EDVs进行细胞特异性基因组编辑 来源:Nature Biotechnology
隐藏在细胞膜碎片中的颗粒,如逆转录病毒样颗粒(VLPs)、细胞外囊泡和仿生纳米颗粒,在运送分子货物方面越来越受欢迎。对于这类EDVs,需要生物工程来实现分子货物包装以及靶向和融合活性的控制。该已经表明,通过将VSVGmut与包装Cas9核糖核蛋白(RNP)复合物的EDV(Cas9-EDV)上的抗体衍生单链可变片段(scFvs)配对,可以在体内和体外实现人类细胞特异性基因组编辑。
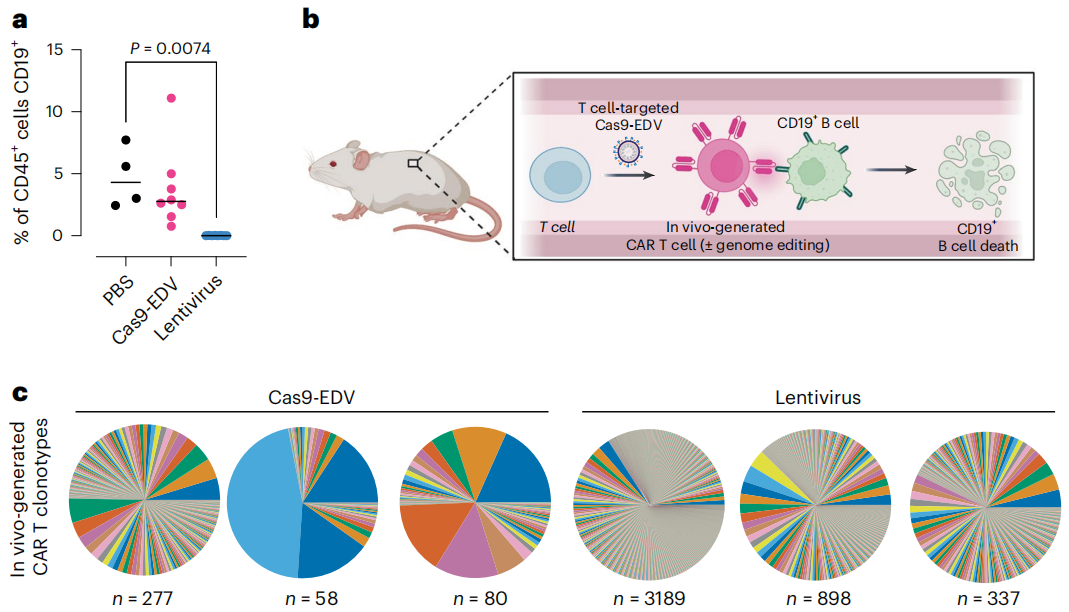
图3:体内细胞工程的功能动力学 来源:Nature Biotechnology
该研究描述的EDVs利用逆转录病毒VLP组装实现Cas9 RNPs的瞬时递送。该研究发现Cas9-EDVs在具有人源化免疫系统的小鼠体内产生的嵌合抗原受体(CAR)T细胞中实现了靶向基因组编辑,而不会脱靶递送到肝细胞。这些数据表明,EDVs是一个可编程的平台,可以将分子货物运送到特定的细胞类型,以进行体内复杂的基因组工程,包括基因递送和靶向基因破坏。
来源:生物探索
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。