Nature:ASO疗法治疗毛细血管扩张性共济失调综合征(A-T)效果良好
基因组学的发展使人类得知遗传疾病的本质——源于基因本身的突变。如果能修正这些基因突变,使其恢复正确形式,就可以从根本上治愈人类遗传病。剪接转换反义寡核苷酸(Splice-switching ASO)可用于治疗遗传疾病,但一种遗传病往往有多种突变形式,ASO只能针对其中一部分,如何系统地甄别这些个体仍然是一个挑战。
近日,波士顿儿童医院和韩国科学技术院的研究人员在 Nature 期刊发表了题为:A framework for individualized splice-switching oligonucleotide therapy 的研究论文。
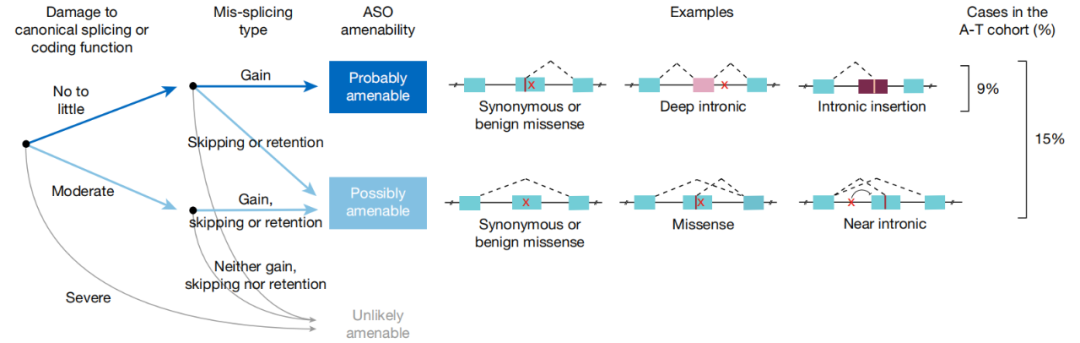
该研究开发了一种预测分类法来评估每个患者对剪接转换ASO的适应性,并表明15%的毛细血管扩张性共济失调综合征(A-T)患者可通过个性化ASO治疗干预得到恢复。这些研究结果为前瞻性识别可能受益于涉及ASO的治疗方法的遗传性疾病个体提供了一个框架。

据估计,全球范围内大约有十分之一的人患有一种罕见疾病,其中有相当比例具有已知或假定的遗传病因,但只有大约5%的人得到有效治疗。这些疾病的罕见性常常使得开发基于传统模式的治疗方法在经济上不可行。
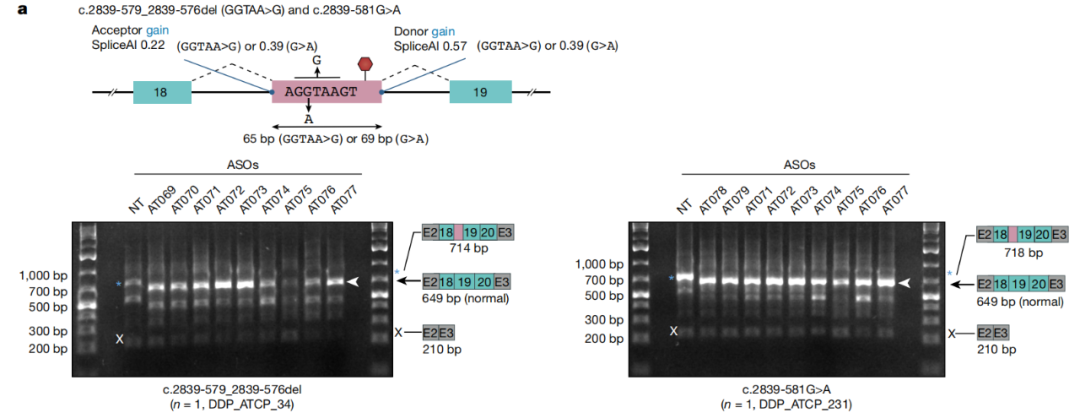
之前的研究表明,在某些情况下,剪接转换ASO可以恢复功能蛋白水平,并能安全、及时地给药。这种治疗为罕见遗传病提供了一个治疗机会。然而,如何识别适合这种治疗的基因变异个体仍然是一个挑战。
在这项最新研究中,研究团队提出了一个框架,使用毛细血管扩张性共济失调综合征(A-T)作为研究模型,以系统性发现和开发罕见疾病患者的ASO疗法。
在“经典”A-T患者(最典型和最普遍的临床表现)中,患者平均预期寿命为25岁,最常见的早死原因是由于肺部疾病或癌症。在许多国家,A-T是最常见的遗传性儿童进行性共济失调的形式,但缺乏有效的治疗方法,特别是对于严重影响生活质量的神经系统表现。
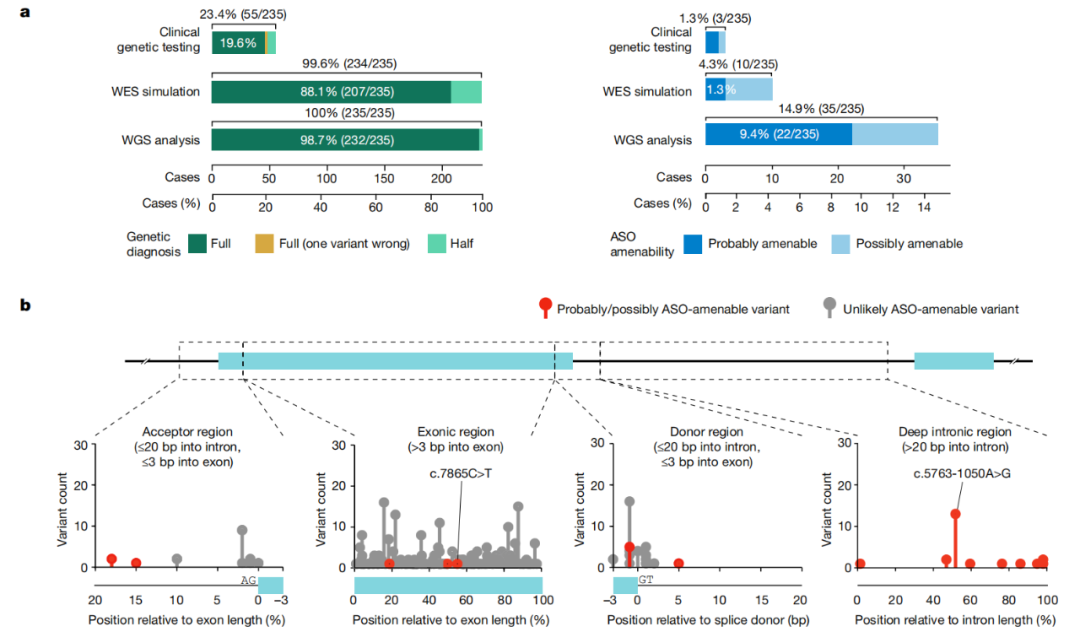
预测结果表明,分别有9%和6%的A-T个体具有“可能”(probably)或“很可能”(possibly)可接受ASO剪接调节的遗传变异,大多数易接受的变异都位于外显子靶向测序无法获得的深层内含子区域。

研究团队还注意到,在235名A-T患者的队列中,有35名患者具有ASO易治疗变异。进一步研究显示,只需要用5种ASO就可以治疗其中约70%的个体,而治疗所有35名患者需要15种不同的ASO药物。
这表明在传统的“一次一药”模型下开发个性化剪接转换ASO治疗的机遇和挑战。这些机遇和挑战将适用于其他特定变异的治疗策略(例如CRISPR基因编辑疗法),强调了对创新的、基于平台的科学和监管方法来释放其潜力的必要性。
总而言之,这项发表于 Nature 的研究为个性化基因治疗如何工作提供了一个框架:利用基因组测序和分析来有效地识别可能适合剪接转换ASO干预的变异,及时设计、测试和部署合适的ASO。如果成功,这些方法将鼓励人们重新评估哪些基因是“可被纠正的”,由此开辟“基因治疗”的新时代!
https://www.nature.com/articles/s41586-023-06277-0