利用天然细胞融合蛋白,创造出新型基因治疗递送载体,可特异性靶向骨骼肌
导语:包膜病毒进入细胞是由病毒融合蛋白介导的,该蛋白驱动病毒和靶膜融合所需的膜重排。骨骼肌的发育也需要祖细胞之间的膜融合事件来形成多核肌纤维。Myomaker和Mymerger是肌肉特异性的细胞融合原,但在结构或功能上与经典的病毒融合原不同。肌肉融合原是否可以在功能上替代病毒融合原,并将病毒融合到细胞中,这点值得探索。
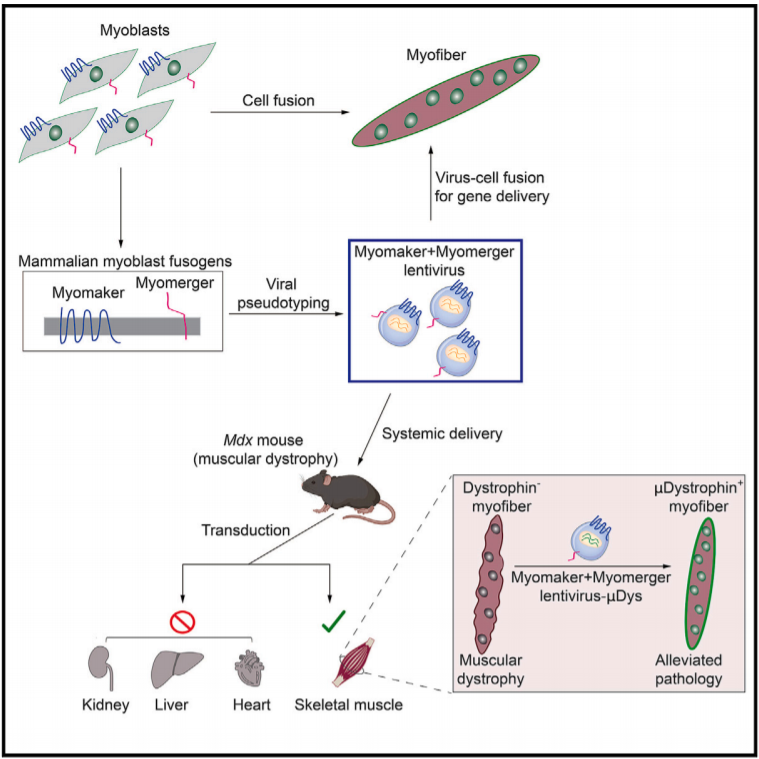
近日,辛辛那提儿童医院医学中心Douglas P. Millay团队在Cell在线发表了题为“Enveloped viruses pseudotyped with mammalian myogenic cell fusogens target skeletal muscle for gene delivery”的研究论文,该研究在包膜病毒膜上表达了Myomaker和Myomerger,可实现病毒特异性转导骨骼肌。
该研究还证明了局部和全身注射带有肌促原假型的病毒粒子可以将μDystrophin传递到小鼠杜氏肌营养不良模型的骨骼肌并减轻病理。通过利用肌原膜的固有特性,该研究建立了一个将治疗材料输送到骨骼肌的平台。
图1.Cell官网截图
膜融合对于细胞间的分子运动、受精、多核细胞的发育和病毒感染至关重要。两种膜的融合是细胞和被包膜病毒进入新结构域的一种机制,其中细胞-细胞融合导致分离的细胞内容物混合到合胞细胞质中,病毒-细胞融合导致病毒基因组进入细胞。膜融合是由融合原直接介导的,融合原是一类通过多种结构和生化机制重塑膜的蛋白质。
鉴于其驱动病毒进入细胞的功能,病毒融合原在异种系统中用于控制遗传物质或细胞物质向细胞的传递。事实上,水疱性口炎病毒G蛋白(VSV-G)是水疱性口炎病毒(VSV)的融合原,并在实验室和临床环境中用于其他包膜病毒转导一系列广泛的细胞类型。这一过程被称为假分型,并与来自病毒、植物和蠕虫的结构保守的融合原一起用于研究融合机制和优化病毒靶向和转导效率。哺乳动物细胞-细胞融合原在其他系统中表现出最小的同源性,是否可以替代病毒的融合原并介导病毒与细胞之间的融合尚不清楚。
Myomaker和Myomerger(也称为Myomixer/Minion)是在骨骼肌发育和再生过程中控制祖细胞融合形成多核肌纤维的融合原。这些蛋白的表达在肌肉中受到空间和时间的控制,它们不存在于静止的卫星细胞中,而是仅在活化的肌原细胞中表达,然后在成熟的肌纤维中不表达。Myomaker和Mymerger是成肌细胞融合所必需的完整膜蛋白,它们的表达可诱导正常不融合的细胞融合。然而,Myomaker和Myomerger不具有典型的可以与跨膜相互作用的经典融合原的长胞外结构域。
图2.文章模式图(图源:Cell )
由于肌肉融合原只在骨骼肌中起作用,它们在病毒膜上的包涵可能使病毒靶向肌肉。如果Myomaker和Mymerger可以改变包膜病毒对骨骼肌的趋向性,它可以帮助提供治疗方式,矫正遗传性肌肉疾病,如肌肉萎缩症,这个极具有挑战性的疾病。目前的方法包括通过腺相关病毒(AAV)进行基因修复,该方法在临床前模型中显示出巨大的疗效,但尚未实现全面的临床应用。
相比之下,治疗性包膜病毒的开发尚未进展到在临床前模型中有效,即使它们具有理想的特征,包括更大的包装容量、整合到基因组中、干细胞的转导以及重新给药的潜力。带有病毒融合原的假型慢病毒载体可以转导营养不良的肌纤维和肌肉卫星细胞,但效率相对较低,并且由于对病毒假型的免疫反应而无法实现全身递送。无法将包膜病毒特异性和有效地靶向骨骼肌仍然是这类运载工具的主要障碍。
该研究结果表明Myomaker和Mymerger可以在没有细胞机制完全补充的情况下驱动基本膜的融合。因此,该研究报道了一类特殊的包膜病毒的产生,其中Myomaker和Mymerger可以在功能上替代天然病毒融合原,并直接感染特异性地针对肌源性靶点,以传递治疗物质。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00330-6
文章来源于iNature