又一款眼科AAV基因治疗申报临床
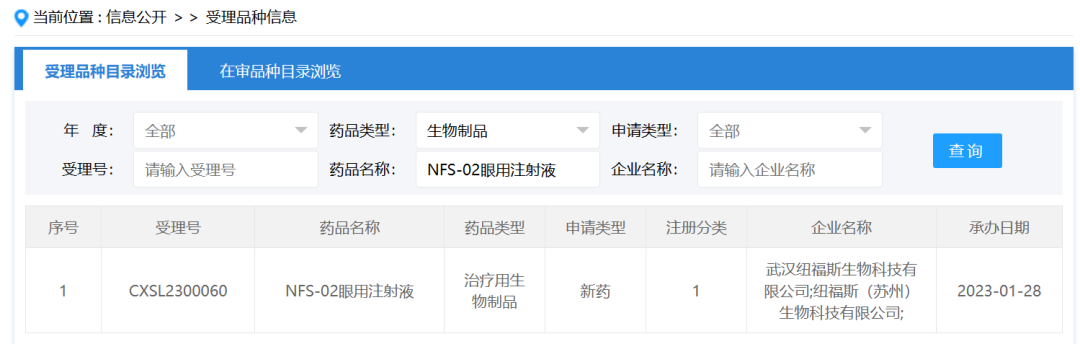
2023年1月28日,国家药监局药品审评中心(CDE)官网显示,纽福斯生物的“NFS-02眼用注射液”临床试验申请,已经获得受理。
关于NFS-02
NFS-02是一种重组腺相关病毒血清型2载体(rAAV2)的新型眼内注射基因治疗产品,正在开发用于治疗与ND1突变相关的Leber遗传性视神经病变(LHON)。
NFS-02以重组腺相关病毒作为载体,通过单次玻璃体内注射,将正确的基因通过玻璃体腔注射递送至患者受损的视神经节细胞,修复线粒体生物呼吸链,使视神经节细胞恢复活力与视功能。
值得注意的是,NFS-02已经在美国获得IND批准,正在进行一项1/2期临床研究,用于治疗ND1线粒体基因突变引起的Leber遗传性视神经病变。此前,NFS-02已经获得美国FDA授予的孤儿药认证。
NFS-02是纽福斯生物向CDE申报的第二款AAV基因治疗。2021年1月19日,纽福斯生物的眼科AAV基因治疗“NR082眼用注射液”的临床试验申请获得CDE受理,并于同年获得临床批件,用于治疗Leber遗传性视神经病变(G11778A突变)。
逐渐起步的AAV基因治疗
相较于细胞治疗的迅猛发展,我国的AAV基因治疗发展相对较慢。
2021年1月19日,CDE正式受理了纽福斯生物的眼科AAV基因治疗“NR082眼用注射液”的临床试验申请——才拉开国内AAV基因治疗的监管之路,开始新一轮的竞速。注:这里的AAV基因治疗指狭义的AAV基因代替治疗,2019年舒泰神申报的STSG-0002,是一款利用AAV作为载体的RNAi疗法,不属于基因代替治疗,因此不算入本文的统计范围。
2021年,共有四家企业向CDE提交AAV基因治疗的临床试验申请,包括纽福斯生物(申报首款AAV基因治疗Leber遗传性视神经病变)、信念医药(申报首款全身AAV基因治疗血友病B)、诺华(基因治疗SMA)以及联盟单位——锦篮基因(申报AAV基因治疗LPLD)。
从小编总结的下图中,可以观察到,时间进入到2022年,CDE受理的AAV基因治疗临床申请数量从3项飞跃至33项,涉及12家企业的16款产品,其中有22项获得了临床默示许可(图中*代表)。
此外,观察图表可以发现,眼科适应症和全身性疾病的产品数量基本持平,全身适应症集中在B型血友病和SMA,未来潜在的竞争强度不小。
文章来源于 佰傲谷BioValley