仅需一次给药!国内首款血友病AAV基因治疗新药获批上市!
2025年4月10日,NMPA官网显示,信念医药的1类新药波哌达可基注射液(商品名:信玖凝,研发代号:BBM-H901)获批上市,用于治疗血友病 B(先天性凝血因子Ⅸ缺乏症)成年患者。
这是国内首个获批上市的AAV基因治疗药物,也是首个针对罕见病的基因治疗药物,曾先后被NMPA纳入突破性疗法和优先审评通道。
截图来源:NMPA官网
信念医药是国内AAV基因治疗先驱。BBM-H901是该公司管线内首款商业化上市的新药,具有里程碑意义,有望成为最优B型血友病基因疗法。
值得一提的是,此前于2023年10月,信念医药已经宣布与武田达成合作,授予武田BBM-H901在中国内地、中国香港和中国澳门的商业化权益。双方将结合各自领域的优势和资源,加速推动该产品的商业化进程,助力B型血友病患者获得创新治疗新选择。
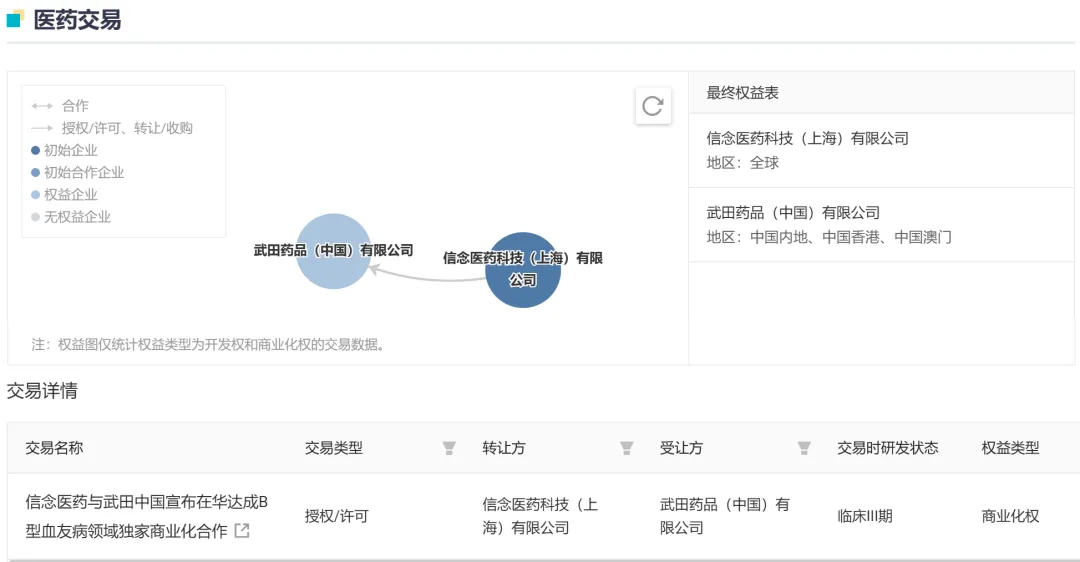
截图来源:Insight 数据库,下同
BBM-H901是信念医药拥有自主知识产权的AAV基因治疗药物,通过静脉给药将人凝血因子 IX(Factor IX,FIX)基因导入血友病B患者体内持续表达,从而提高并长期维持患者体内凝血因子水平,以期达到「一次给药、长期有效」的治疗及预防出血效果。
Insight数据库显示,BBM-H901在各临床试验登记平台上共计启动了3项临床试验,其中注册III期临床结果已经在2024年ASH年会上公布。
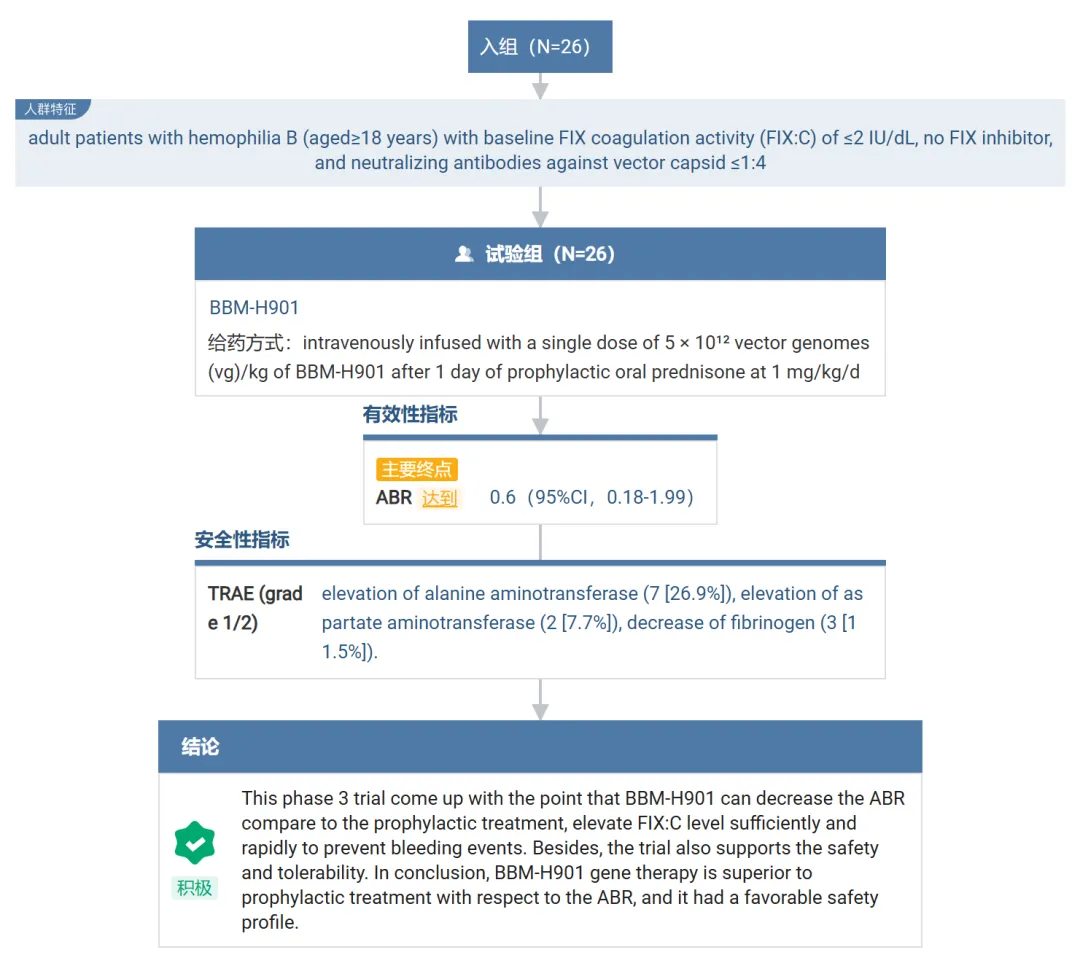
该研究是一项多中心、单臂、III期临床研究(NCT05203679),旨在评估单次静脉输注BBM-H901注射液治疗血友病B患者的安全性和有效性。研究的主要终点包括BBM-H901注射输注后52周内的年化出血率(ABR)。
研究结果显示,相较于预防性FIX替代疗法,BBM-H901注射液能够显著降低患者的ABR,快速提升患者体内FIX活性水平并持续稳定表达,从而预防出血事件。与此同时,研究数据亦显示该款药物具有良好的安全性和耐受性。
截至2023年4月21日,26例中国受试者成功入组并且完成BBM-H901注射液(5×10¹²vg/kg)的单次静脉输注治疗。52周随访数据如下:
-
受试者平均ABR为0.6(95%Cl:0.18-1.99),显著低于优效性界值5.0(国内预防治疗人群确定的ABR); -
输注后第52周,平均FIX活性达到55.08IU/dL(SD35.93)(一期法SynthASil);输注后第3天,平均FIX活性已经升至49.70IU/dL(一期法SynthASil); -
52周FIX药物的平均输注次数,从治疗前的58.2次(SD 30.67)降至治疗后的2.9次(SD 10.71)。21例受试者(80.8%,21/26)在治疗后未出现出血事件。平均靶关节数从治疗前的1.1(SD 1.2)降至治疗后的0; -
无严重不良事件、无FⅨ抑制物阳性的不良事件、无血栓栓塞事件、无3-4级不良事件。
除本次获批的BBM-H901之外,信念医药还有5款临床阶段新药在研,均为基因治疗药物,适应症覆盖A型血友病(BBM-H803)、杜氏肌营养不良症(BBM-D101)、帕金森病(BBM-P002)、人乳头瘤病毒感染(BBM040)等。
其中,BBM-D101已经获得美国FDA孤儿药及儿科罕见病双重资格认定;BBM-H901和BBM-H803注射液也获得美国FDA授予的孤儿药认定。