全球首个治疗SOD1-ALS的ASO药物在中国免临床获批上市!
2024年10月08日,中国国家药监局(NMPA)最新公示,渤健的获批进口,用于治疗SOD1基因突变的成人肌萎缩侧索硬化症(ALS,也被称为“渐冻症”)。这是全球首个SOD1-ALS对因治疗药物,在国内通过免临床途径获批上市。

ALS是一种罕见、进行性、致命的神经退行性疾病,可导致大脑和脊髓中负责控制随意性肌肉运动的运动神经元丢失。ALS患者会出现肌肉无力和萎缩,导致他们失去独立性,逐渐失去了活动、说话、进食和呼吸的能力。症状发作后,ALS患者的平均预期寿命为3至5年。研究表明,多个基因与ALS有关,基因检测有助于确定个体患有的ALS是否与基因突变有关,即使在没有该疾病家族史的个体中也是如此,超过15%的ALS患者被认为由遗传导致,但这些患者可能没有已知的疾病家族史。
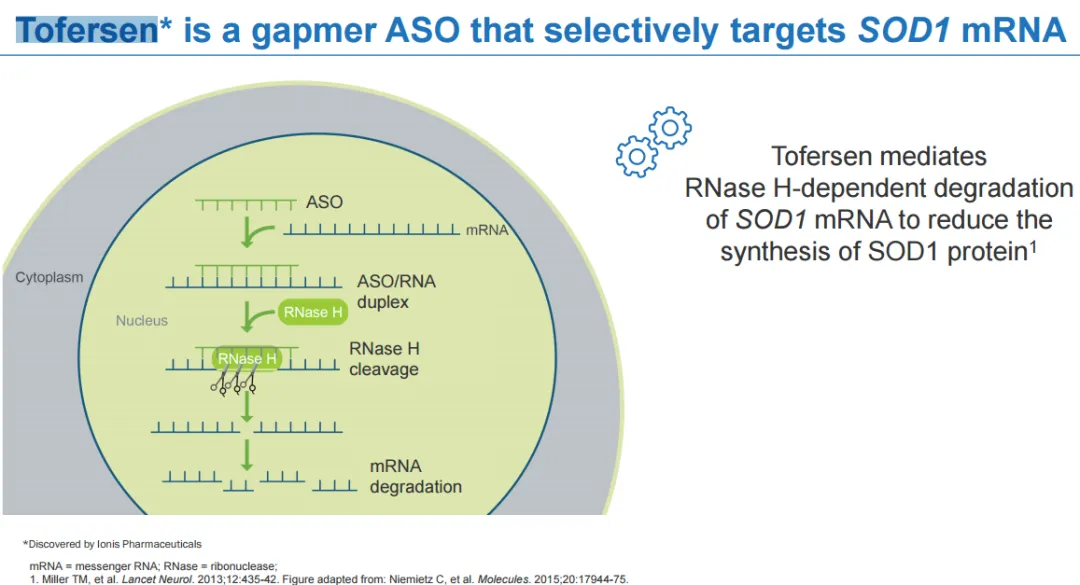
托夫生(Tofersen)是一种反义寡核苷酸药物(ASO),通过与SOD1 mRNA 结合引起SOD1 mRNA降解,从而减少SOD1蛋白合成。
2023年04月率先在美国获批上市,是目前唯一一款针对 SOD1-ALS 的对因治疗药物。2024年05月获 EMA批准用于ALS。
在一项为期28周的随机、双盲、安慰剂对照临床研究(VALOR研究)中,研究者评估了Tofersen治疗由ALS引起虚弱且由中心实验室确认存在SOD1突变的患者的疗效,这些患者年龄为23岁至78岁。108名患者以2:1的比例随机接受Tofersen 100mg(n=72)或安慰剂(n=36)治疗,治疗持续24周(3次负荷剂量、随后5次维持剂量)。患者被允许同时使用利鲁唑和/或依达拉奉,在基线时,62%的患者使用利鲁唑,8%的患者使用依达拉奉。
在该VALOR研究的28周时,与安慰剂组相比,接受Tofersen治疗的主要分析人群受试者(n=60)ALS功能评分修订量表(ALSFRS-R)相比基线的下降程度更小,尽管结果无统计学意义(Tofersen/安慰剂组间调整后均数差[95%CI]:1.2[-3.2,5.5])。在总体意向治疗人群(n=108)中,Tofersen治疗组受试者的血浆NfL水平降低了55%,安慰剂组升高了12%(Tofersen/安慰剂组间几何平均比差异:60%;标称p<0.0001)。此外,Tofersen治疗组患者的CSF SOD1蛋白水平(靶点作用的间接指标)降低了35%,安慰剂组降低了2%(Tofersen/安慰剂组间几何平均比差异:34%;标称p<0.0001)。
在完成VALOR研究并参与开放标签扩展(OLE)研究的受试者中,52周中期分析结果显示,先前接受安慰剂并在OLE研究中启用Tofersen的受试者NfL水平出现下降,下降幅度类似于在VALOR研究中接受Tofersen治疗的受试者。与使用安慰剂/延迟启用Tofersen的患者相比,早期启用Tofersen与临床功能(ALSFRS-R)、呼吸强度(慢肺活量预测百分比)和肌肉力量(手持式测力评分)等指标呈现的衰退减缓趋势相关,尽管在统计学上并不显著。Tofersen还与降低死亡或永久通气风险有关,呈现非统计学显著的趋势。鉴于在对照研究之外收集的数据有限,应谨慎解释这些探索性分析结果,数据可能会造成混淆。
Tofersen的获批基于来自VALOR临床研究及其OLE研究的12个月综合结果,后者旨在比较早期启用Tofersen(在VALOR研究开始时)和延迟启用Tofersen(在六个月后的OLE期)的治疗结果。这些结果已发表于《新英格兰医学杂志》。
来源:细胞科技网
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。