关于近日三个基因疗法审批进展 涉及治疗血友病A、LGMD、DEB
联盟时刻留意基因疗法的进展,本期将分享近日三个基因疗法BBM-H803、AB-1003、Vyjuvek的相关资讯。
治疗血友病基因疗法BBM-H803临床试验IND受理
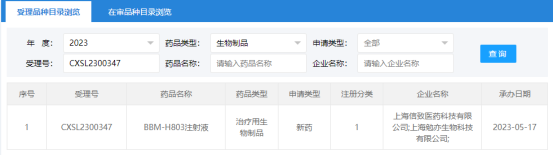
图1.来源:CDE官网
近日,据国家药监局药品审评中心(CDE)官网信息显示,信念医药公司(Belief BioMed,BBM)全资子公司上海信致医药科技有限公司和上海勉亦生物科技有限公司申报的“BBM-H803注射液”临床试验申请获得受理(受理号:CXSL2300347),用于治疗血友病A。
BBM-H803注射液是信念医药拥有自主知识产权的AAV基因治疗药物,通过静脉给药将人凝血因子Ⅷ(Factor Ⅷ,FⅧ)基因导入血友病A患者体内,从而提高并长期维持患者体内凝血因子水平,以期达到“一次治疗、长期有效”的治疗及预防出血效果。
BBM-H803注射液药物的设计采用了拥有完全自主知识产权的肝靶向性血清型和高效基因表达盒,运用公司自主开发的无血清悬浮培养和层析工艺进行符合GMP要求的药物生产。2022年12月BBM-H803曾获得FDA的孤儿药认定。这也是信念医药第二款获得FDA孤儿药认定的基因治疗药物。另一款AAV基因疗法BBM-H901于2022年8月获得FDA的孤儿药认定并被CDE纳入突破性治疗品种名单,用于治疗血友病B,该款产品目前正处于Ⅲ期临床试验阶段。
治疗肢带型肌营养不良基因疗法AB-1003获EC孤儿药资格认定
拜耳公司的全资和独立运营子公司Asklepios 生物制药公司宣布,欧洲委员会(EC)已授予AB-1003(也称为LION-101)孤儿药资格认定,用于治疗肢带型肌营养不良(limb-girdle muscular dystrophy ,LGMD)。AB-1003是一种新型研究性重组腺相关病毒(AAV)基因疗法,目前正在开发中,可一次性静脉(IV)输注治疗LGMD2I/R9型(LGMD2I/R9)患者,这是一种影响全球百万分之4.5人的疾病亚型,其中包括欧盟和美国的5000多人,遵循欧洲药品管理局孤儿药品委员会(COMP)的肯定意见,并通过AskBio位于欧盟的子公司BrainVections获得。AB-1003正在美国进行一项1/2期多中心研究,该研究将评估基因确诊的LGMD2I/R9成年受试者单次静脉输注基因治疗的安全性、耐受性和疗效。AskBio联合创始人兼首席执行官Sheila Mikhail表示:“欧盟授予AB-1003孤儿药资格认定是对LGMD未满足医疗需求的重要认可,因为LGMD尚无获批治疗方法。这种罕见型肌营养不良给患者及其家人带来巨大负担。”
欧盟委员会授予用于治疗危及生命或慢性衰弱疾病的药品孤儿药资格认定,这种疾病在欧盟的发病率不超过万分之五,且没有其他令人满意的治疗方案,或者该药物对受特定疾病影响的人有重大益处。这一资格认定将在欧盟提供特殊激励措施,包括获得方案援助的资格以及某些监管费用的豁免或减免。此外,如果该药物批准上市,将提供10年的上市独占期。
首款可“重复使用”的基因疗法VYJUVEK获FDA批准
图2.来源于GlobenewsWire
2023年5月19日,Krystal Biotech公司宣布,美国食品药品监督管理局(FDA)已批准VYJUVEK上市,用于治疗6个月以上患有营养不良性大疱性表皮松解症(DEB)的患者。VYJUVEK是有史以来第一个可重复使用的基因疗法,也是FDA批准的用于治疗DEB(包括隐性和显性)的唯一药物,可以在医疗专业人士或家庭环境中进行治疗。
VYJUVEK是一种非侵入性、局部、可重复使用的基因疗法,旨在通过基因工程改造的HSV-1载体来进行基因递送,向患者的皮肤细胞提供两个正常拷贝的COL7A1基因,生成功能性Ⅶ型胶原蛋白(COL7)来解决导致DEB的根源问题,以实现伤口愈合和持续的COL7蛋白表达。
参考来源:细胞与基因治疗领域、罕见病信息网、柯西CRO