文献分享丨张锋团队开发最小化免疫原性的CRISPR核酸酶
利用CRISPR-Cas系统进行基因组编辑,是治疗遗传疾病的有前景的途径。2023年底,美国FDA批准了首款CRISPR基因编辑疗法上市,此外,还有许多基于 CRISPR 的基因编辑疗法正在临床试验中,用于治疗多种遗传疾病,包括视网膜营养不良、血友病、溶酶体贮积病以及某些类型的癌症。
然而,源自细菌的Cas核酸酶的细胞和体液免疫原性,很大程度上限制了 CRISPR 基因编辑疗法的临床应用。
2025年1月2日,张锋团队在Nature Communications期刊发表了题为:Rational engineering of minimally immunogenic nucleases for gene therapy的研究论文。
该研究对用于CRISPR基因编辑治疗的 Cas 核酸酶SaCas9和AsCas12a进行了理性工程化改造,设计出了具有最小化免疫原性的SaCas9和AsCas12a突变体,在保持与野生型相当活性和特异性的情况下,显著降低了免疫原性。
这项研究为改造治疗性蛋白以降低免疫原性提供了框架,并为开发更安全的基于 CRISPR的基因编辑疗法奠定了基础。
迄今为止,大多数基于CRISPR的基因编辑疗法依赖于以下三种 Cas 核酸酶之一:化脓链球菌Cas9(SpCas9)、金黄色葡萄球菌Cas9(SaCas9)和氨基酸球菌 Cas12a(AsCas12a)。在这三者中,SaCas9和AsCas12a 是大多数体内治疗策略的重点,因为它们的尺寸较小,可以被包装到腺相关病毒(AAV)载体中,而AAV载体是体内基因治疗的主要递送方式。
除了有效递送以外,CRISPR基因编辑疗法在体内应用的第二个挑战在于其潜在的免疫原性,尤其是由于它们是细菌来源的,许多患者对微生物来源的分子已有预先存在的接触和免疫反应。据报道,80%的健康个体对金黄色葡萄球菌和化脓链球菌来源的蛋白质具有体液免疫(由抗体介导)和细胞免疫(由T细胞介导)。
这种预先存在的免疫反应也适用于Cas核酸酶,对健康人类捐赠者的血液分析显示,78%的人对SaCas9产生了类别转换的免疫球蛋白(IgG)抗体,58%的人对 SpCas9有抗体,所有对Cas9细胞免疫呈阳性反应的捐赠者也都有抗体活性,这表明适应性免疫和体液免疫之间存在高度一致性。
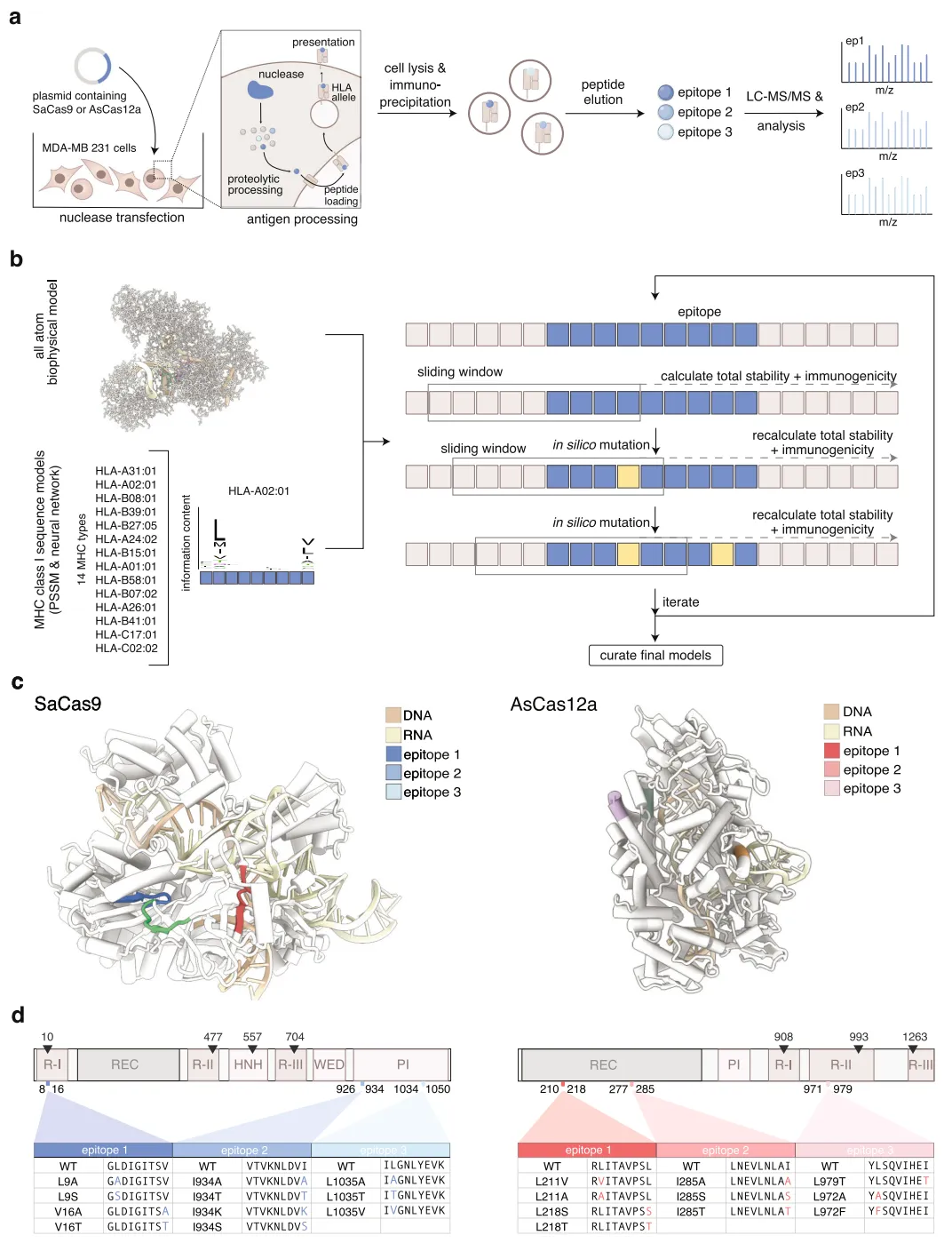
为了解决上述挑战,研究团队对SaCas9和AsCas12a进行了分析,以确定假定的免疫原性表位,然后计算设计了预计可以逃逸免疫检测的突变体。
预测与MHC I 结合力降低的SaCas9和AsCas12a表位
然后,研究团队通过实验验证了这些突变体,结果显示,它们在体外消除了CD8+T细胞的反应性,同时保持了天然水平的核酸酶活性和特异性。研究团队进一步证明,在具有免疫活性的MHC I/II 类的人源化小鼠模型中,与野生型核酸酶相比,SaCas9突变体有效地减少了体液免疫反应和细胞免疫反应。
具体来说,该研究报道了两种已在临床使用的SaCas9和AsCas12a核酸酶的免疫原性降低的突变体,通过MHC相关肽蛋白质组学(MAPP)分析,确定了每个核酸酶上假定的免疫原性表位。利用计算模型进行理性设计以逃避免疫反应。适应性免疫组分对SaCas9和AsCas12a的低免疫原性突变体(SaCas9.Redi和AsCas12a.Redi)的识别能力明显较低,包括与MHC分子的结合亲和力降低,以及产生细胞毒性T细胞应答的能力减弱,与此同时,这两种突变体可保持与野生型相当活性和特异性。
在体内编辑实验中,SaCas9.Redi.1对PCSK9基因的编辑与野生型SaCas9相当,但显著降低了不期望出现的免疫反应。证明了该方法在工程化设计蛋白以逃逸免疫检测中的有效性。
这些结果为改造治疗性蛋白以降低免疫原性提供了框架,并为开发更安全的基于 CRISPR的基因编辑疗法奠定了基础。