引言
2025年7月,FDA批准PTC Therapeutics的Sephience® (sepiapterin) 上市,为苯丙酮尿症 (PKU)提供了新的口服辅因子替代疗法。本文将深入解析PKU的遗传学基础、Sephience的作用机制,并重点关注ASGCT 2025年会上展示的,基于"等位基因沉默+功能重建"双效策略的AAV基因治疗(如GS1168)如何为PKU的"一次性治愈"带来新曙光。
PKU的遗传学机制:PAH基因突变与苯丙酮尿症治疗靶点
苯丙酮尿症 (Phenylketonuria, PKU) 是一种常染色体隐性遗传的罕见病,其致病根源在于PAH (Phenylalanine Hydroxylase) 基因的突变。
PAH基因(定位于12q22-q24.2)编码肝脏特异性的苯丙氨酸羟化酶(PAH),该酶负责将必需氨基酸苯丙氨酸 (Phe) 转化为酪氨酸。这一过程高度依赖其辅因子——四氢生物蝶呤 (BH4)。
目前,已报道的PAH致病性变异超过1000种。这些变异类型多样,包括错义突变、无义突变、剪接位点突变和缺失等,导致PAH酶功能部分或完全丧失。当PAH酶活性不足时,Phe在体内蓄积,产生神经毒性,导致不可逆的智力损伤。
值得注意的是,相当一部分PKU患者携带的错义突变会导致PAH蛋白对辅因子BH4的亲和力降低或稳定性下降。这一机制是"BH4反应型PKU"的分子基础,也是辅因子替代疗法的理论基石。
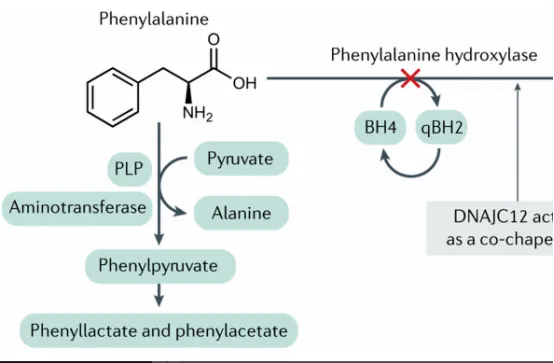
苯丙酮尿症治疗新药:Sephience (Sepiapterin)的辅因子机制
FDA的批准使Sephience成为苯丙酮尿症治疗的重要补充。它是一种口服的天然BH4前体替代物。
作用机制
Sepiapterin通过内源性补救途径被吸收并转化为BH4,绕过了BH4合成途径中的限速步骤,从而更有效地提高肝细胞内BH4水平。这对于那些因PAH突变导致酶-辅因子亲和力降低的患者尤为关键。通过补充足量的辅因子,Sephience能够"激活"并稳定残留的PAH酶活性,恢复Phe代谢通路。
临床证据
关键的III期APHENITY临床试验 (NCT04849767) 数据显示,Sephience治疗显著降低了PKU患者的血浆Phe水平,平均降幅超过30%。
PKU基因治疗前沿:"一次性治愈"的双效策略 (GS1168)
尽管辅因子替代疗法取得了进展,但它仍属于对症缓解。因此,实现"一次性治愈"的PKU基因治疗成为了研究的核心前沿。
在2025年的美国基因与细胞治疗学会 (ASGCT) 年会上,针对PKU的基因治疗研究展示了令人振奋的突破。例如,华毅乐健报告的候选药物GS1168,其创新的"双效一体治疗策略"引起了广泛关注。
核心挑战
许多患者体内表达的突变型PAH蛋白(mutant PAH)会对AAV表达的野生型PAH(wild-type PAH)功能产生显性负向干扰 (Dominant Negative Effect)。
GS1168的双效机制
为解决这一难题,GS1168采用了一种精妙的"等位基因沉默+功能重建"策略,并将两种机制集成于一个AAV载体中:
- 打破干扰 (等位基因沉默): 载体表达一个优化的microRNA (miRNA) 模块,特异性识别并沉默患者内源性的、突变的PAH mRNA。
- 重建功能 (RNAi耐受表达): 载体同时表达一个密码子优化且RNAi耐受的PAH蛋白,使其在不改变氨基酸序列的前提下,避开miRNA的识别位点。
科研启示:PKU基因治疗的未来方向与动物模型
从Sephience的获批到GS1168的机制创新,PKU的治疗范式正在从"代谢控制"转向"基因修复"。这一进展为科研工作者提供了重要启示:
- 等位基因特异性操作是关键: GS1168所展示的等位基因特异性沉默(Allele-Specific Silencing)结合功能替换的策略,为其他具有类似挑战的遗传病(如某些肝病、神经疾病)提供了可借鉴的研发思路。
- 动物模型的精准构建至关重要: 为了验证GS1168这类复杂的双效AAV载体,研究人员必须使用能够模拟人类显性负向效应的PKU动物模型(例如,携带特定PAH点突变的基因敲入小鼠),而非简单的Pah基因敲除(KO)模型。
内容来源与免责声明
本文是对近期行业动态(包括FDA批准和ASGCT 2025年会)的编译和解读,旨在展示相关领域的科研进展。所有信息均基于公开数据和引用的参考文献。






