文献分享丨美国罕见病药物研发激励政策实践及启示—基于药品全生命周期视角
一、摘要
通过梳理美国罕见病药物研发的相关激励政策,为我国罕见病药物研发激励保障体系的建设与完善提供参考依据。收集整理美国的罕见病研发激励政策及实践经验,基于药品全生命周期视角对各环节的激励措施进行分析与总结,并结合我国政策现状,从罕见病及罕见病药物的认定机制、基础研究、临床研发、上市审批、市场激励和医疗保障等方面为我国罕见病药物研发激励政策体系的建设和完善提供参考建议。完善的罕见病药物研发激励政策体系是推动罕见病药物创新研发的强劲动力和重要保障,而美国作为第一个为罕见病药物立法的国家,在药品全生命周期各环节都设置了较为完善的研发激励措施,拥有较为完善的政策体系和丰富的实践经验。建议我国在建设罕见病药物研发激励政策的过程中,在完善罕见病及罕见病药物身份认定的基础上,逐步形成覆盖药品全生命周期的“1+n”罕见病药物研发激励政策体系,不断推进罕见病药物创新生态环境建设,促进我国罕见病保障事业持续向前发展。
二、关键词
罕见病药物;药物研发;激励政策;药品全生命周期;美国
三、正文
罕见病又称为“孤儿病”,是发病率极低疾病的统称。罕见病虽然少见,但仍影响了全球约3亿人口,在我国的影响范围超过2000万人。全球范围内已发现超过10000种罕见病,但只有不到5%的罕见病有药可治,罕见病药物的可及问题对罕见病保障事业的推进和发展提出了巨大挑战。
为加快解决罕见病患者的用药需求问题,激励罕见病药物的研发上市,美国率先在罕见病领域出台了《孤儿药法案》(Orphan Drug Act,ODA)等系列政策法规,以孤儿药资格认定为激励基础,在药物基础研究、临床研究、上市审批、上市后市场激励及支付保障等环节设立了多项激励措施,逐步形成了覆盖药品全生命周期的“1+n”罕见病药物研发激励政策体系,批准了上千种罕见病治疗药物。而我国目前尚未形成完善的罕见病身份认定机制,相关激励政策仍呈现碎片化的特点,我国对罕见病药物研发的激励力度仍有待加强。
鉴于此,本文基于药品全生命周期视角,对美国罕见病药物研发激励政策进行梳理,为完善我国的罕见病药物研发激励政策体系建设提供参考。
01
药品全生命周期视角下罕见病药物研发面临的困境与挑战
药品的研发上市是一个漫长的过程,通常药物从发现到临床研究再到上市审批的平均生命周期约10~12年,而罕见病由于患者数量少、疾病自然史难获取,临床研究开展难度更大,也导致罕见病药物的开发周期更加漫长,且研究成本与市场规模不平衡、创新主体动力不足、药物供需失常等因素导致的市场失灵也对罕见病药物的研发上市提出了巨大挑战。
本研究以生命周期理论为基础,根据罕见病创新药物的自身特点,将药品研发上市的生命周期划分为基础研究、临床研究、上市审评审批、上市后市场激励和支付保障5个阶段。以上各阶段都面临多种困境和挑战,但不同环节之间的问题环环相扣、层层递进,如罕见病自然史数据的缺乏会影响罕见病和罕见病药物界定标准的确定,界定标准不明晰会进一步影响上市审批的对照标准和审评效率,也会产生市场激励政策作用对象和支付保障纳入对象的覆盖面过窄等一系列问题。除了研发前端的激励措施会对药物研发的积极性产生影响外,上市激励政策不完善也会导致研发创新主体的动力不足,从而影响罕见病药物研发创新生态的良好发展(见图1)。
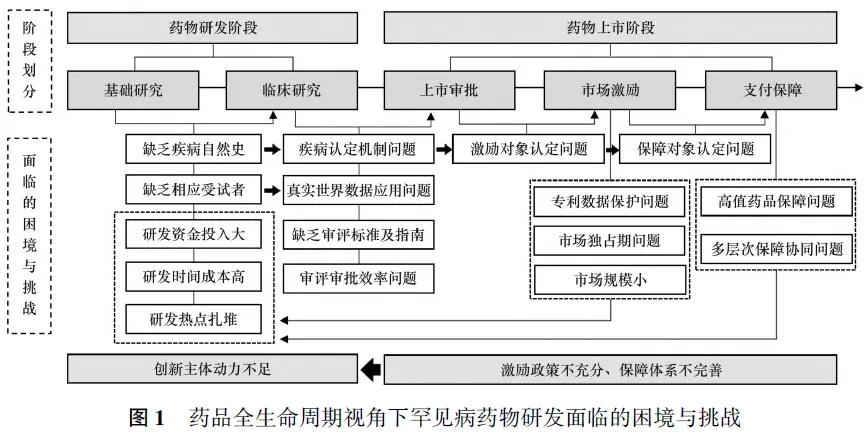
因此,政府从药品全生命周期环节出发建立和完善有效的罕见病药物研发激励政策体系,用积极的政策手段弥补市场不足,可以有效应对漫长且成本高昂的罕见病药物开发生命周期的挑战,并提高罕见病药物的保障水平。
02
美国“1+n”罕见病药物研发激励政策概况
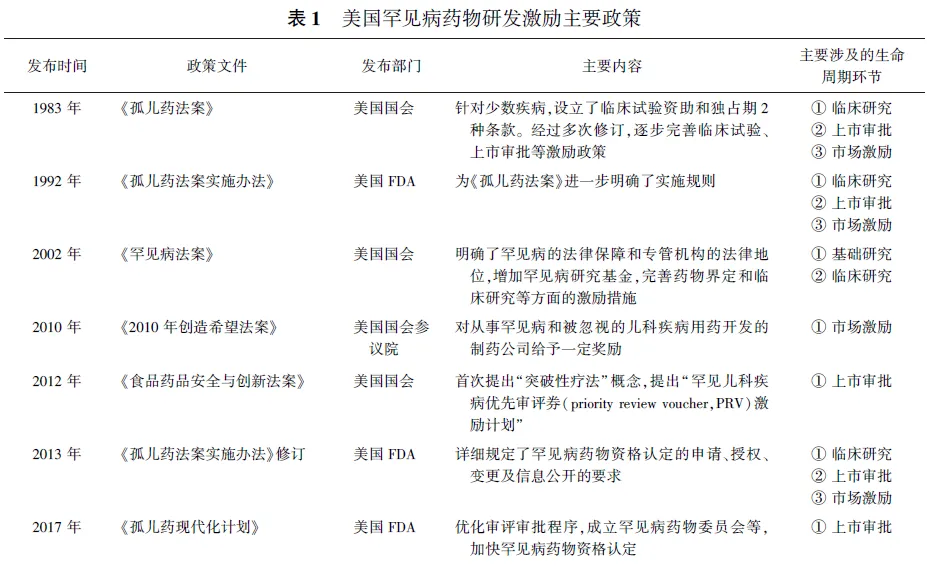
美国是首个在罕见病领域专门立法的国家,拥有较为丰富的罕见病法规政策体系建设经验。自1983年出台《孤儿药法案》以来,美国陆续颁布了《孤儿药法案实施办法》、《罕见病法案》等一系列政策法规,不仅提出将罕见病界定为每年患病人数少于20万人的疾病,还逐步将罕见病药物研发激励政策铺设至药品全生命周期所有环节,对罕见病及罕见病药物的基础研究、临床研究、注册审评审批和市场激励等方面的激励措施做出了具体要求,形成了以“罕见病药物资格认定”为“1”和“多环节激励措施”为“n”的“1+n”罕见病药物研发激励政策体系,至今仍在不断更新和完善(见表1)。

2.1 加强自然病史研究,奠定药物开发基础
罕见病由于发病率和患病率极低的特点,在临床诊断上面临易误诊、难确诊的困难,在新药的开发上也面临疾病认知不足和基础疾病信息缺乏的情况,所以加强对于疾病和病症的理解与认识极为重要。
美国在罕见病基础研究的激励方面布局较早,于1982年设立负责孤儿药研究相关资助项目的孤儿产品开发办公室(Office of Orphan Products Devel⁃opment,OOPD),随后通过孤儿产品资助计划对罕见病自然史研究提供资助,支持前瞻性、回顾性或调查类自然史研究。2019年发布的《罕见病:药物开发的自然史研究行业指南(草案)》,对罕见病的疾病自然史研究设计和实施提供了指导意见,进一步强调了自然史信息对于罕见病药物开发的重要性。
截至2022年,OOPD已经资助了16项罕见病自然史研究,包括3项回顾性研究和14项前瞻性研究,资助金额逾2000万美元。通过鼓励罕见病自然史研究,为后期临床研究和促进治疗药物的开发奠定坚实基础。
2.2 提供临床研究资助,搭建多主体临床研究协作网
除资金支持外,美国也加强了临床研究协作网络建设,通过多主体间的信息交互实现更高效的临床研究。美国国立卫生研究院于2003年设立了罕见病临床研究网络计划,在计划框架下组建了包含20个临床研究联盟的罕见病临床研究联盟(Rare Diseases Clinical Research Consortia,RDCRCs),搭建了由医师、学者及多学科团队与罕见病患者权益团体组成的多主体协作交流网络,开展研究交流和数据共享,并针对未满足的罕见病临床试验需求开展了280多项研究。但受美国国家转化科学推进中心授权限制,RDCRCs支持的临床试验试点项目和培训计划范围仅包括了Ⅱa期临床试验结束之前的项目。
2.3 享受多条加速审评渠道,给予申请审批费用优惠
美国设立了多条加速审评通道以加快推动治疗严重疾病的药物上市,部分临床价值较高的孤儿药可以灵活利用1种或多种特定加速渠道以较大程度地缩短上市时间。美国于1992年建立了优先审评(priority review)和加速审评2条快速审评(accelerated approval)路径,随后又在1997年建立了快速通道(fast track)满足不同的加速审评需求。之后为了进一步刺激特殊药品(如罕见病药物)的快速上市,允许研发企业在新药临床研究审批(investigational new drug,IND)申请后即可提交进入快速审评通道请求,减少了开发时间和成本。美国在2012和2016年又分别建立了突破性疗法(breakthrough therapy)和再生医学先进疗法(regenerative medicine advanced therapy),进一步拓宽加速审评的路径(见表2)。

为了激励儿科罕见病药物的研发创新,美国还提出优先审评券激励计划,对于开发出相关药物的制药企业奖励优先审评资格,从而缩短不符合优先审评药物的审评周期,节省了药物审评的时间成本。
除审评加速外,美国在药物申请审批的费用上也给予了一定优惠。1997年《FDA现代化法案》规定,豁免用于罕见病药物上市申请或新适应证补充申请的费用,2007年《FDA修正案》豁免用于罕见病处方药或生物制品申请批准或许可的产品费及场地费用。
2.4 赋予市场独占权,减免税费
由于罕见病药物市场通常具有市场失灵的特征,即为小患者群体开发和制造药物的成本高、潜在收入低,ODA为罕见病药物提供了市场独占政策以解决这种市场失灵问题。该法案规定,经批准上市的罕见病药物享有7年市场独占期,在此期间,美国FDA不能批准同一产品和同一罕见病适应证的新药申请或仿制药申请。该激励措施解决了在没有专利保护的情况下回收药物研发成本机会有限的问题。
此外,对于成功上市的罕见病药物,临床试验费用的50%可以作为税收抵免,并可向前延伸3年,向后延伸15年,总税收减免费用可达临床研究总费用的70%,2017年将符合规定的临床试验费用税收减免至25%。
2.5 给予企业新药定价权,支持多元支付体系
美国联邦政府制定了一系列激励措施以保障罕见病药物的研发供应,但是并不直接干预罕见病药物的定价。企业可以根据研发成本、市场需求、政策激励和保险覆盖范围等因素,自主确定罕见病药物的价格,这也极大刺激了药物供应和药物创新。同时,在专利保护和市场排他性的环境下,罕见病药物的费用也相对高昂,多数患者的医疗费用都依赖于国家投资的医疗保健计划和私人购买的商业保险,通过选择合适的保险以争取更低的自付费用。
对于罕见病药物支付保障,《孤儿药法案》明确提出商业保险不得拒绝纳入罕见病患者,且对发生灾难性卫生支出的家庭予以95%的报销比(包含所有已上市药物)。在《平价医疗法案》(Affordable Care Act,ACA)中也明确了与之相关的2个要素:①联邦医疗保险(medicare)对罕见病药物没有特殊或不同的承保规则。②法案明确排除联邦医疗保险和医疗补助制度(medicaid)仅根据其成本效益做出任何药物(不仅包括罕见病药物)的承保决定。此外,在联邦医疗保险的补充医疗保险(part B)及处方药计划(part D)两部分都包含了罕见病药物的偿付报销措施,为患者提供了一定的经济保障。
03
对我国罕见病药物研发激励政策的启示
随着罕见病事业的发展,为加大罕见病药物研发上市的激励力度,我国于2018年出台了《第一批罕见病目录》,明确了我国罕见病的管理界限,也为罕见病药物的研发提供了价值导向。“十四五”规划实施以来,各部委专项规划陆续出台,将罕见病融入国家顶层设计,并开展了地方区域先试先行,从激励药物研发和推进多层保障等方面构建罕见病领域的治理框架,取得了很多突破性成果。
随着对罕见病药物研发激励体系建设的要求不断提高,在罕见病药品全生命周期的各个环节中也暴露出界定标准不明晰、研发创新活力不足、激励政策衔接不够紧密及相关方合作不够协同等问题,我国仍需不断汲取先进国家和地区的实践经验,为建设符合我国国情的罕见病药物研发激励政策体系提供可参考的思路和路径。
3.1 健全罕见病身份认定机制,循序渐进完善罕见病立法保障
罕见病的身份认定是我国罕见病药物管理范围和医保药品目录调整的重要基础,目前我国认定罕见病的官方依据是国家卫生健康委员会等部门2018年5月发布的《第一批罕见病目录》和2023年9月发布的《第二批罕见病目录》,共包含207种罕见病。
在疾病认定方面,相较于美国等对罕见病进行专门定义的国家,我国目前尚未基于人群发病率对罕见病进行统计学上的明确界定,且现有目录中所涵盖的病种数远低于世界范围内已知的病种数量。在目录管理方面,现有2批罕见病目录的出台时间间隔为5年,更新频率与当前新药研发节奏、患者用药需求不平衡,对于某些被国内外专家认可但不属于我国法定罕见病的治疗药物,在新药研发上市和境外药物引进环节能否享受激励福利方面存在不确定性。
建议在现行目录的基础上,兼顾人群发病率和目录清单的形式对罕见病采取宽口径的定义。凝聚政府部门、医疗机构、专家学者、患者组织等相关方的力量,加强国家医保部门联合协作,加速目录更新频率,探索出科学合理的常态化罕见病身份认定机制,为后续罕见病的诊疗、药物研发、社会保障等政策的制定进一步提供参考依据。
同时,我国可适时制定罕见病及罕见病药物相关法律。鉴于目前我国社会经济条件有限,短时间内架构起针对罕见病及罕见病药物的立法框架有一定困难,相关部门可围绕罕见病出台专门的指导性政策,并在政策落地后对实施效果进行评估,结合反馈意见不断对其进行优化,从而最终将成熟的政策条例转化为法律或指导原则等,循序渐进推进覆盖罕见病药品全生命周期的立法工作。
3.2 重视罕见病基础研究工作,加大专项资金支持力度
目前,我国已经开展了“重大新药创制”科技重大专项等项目支持和推动罕见病及其治疗药物的相关研究,并通过中央财政科技计划对符合条件的相关科研活动进行支持。但截至2022年,“重大新药创制”专项投入中央财政经费超过200亿元,而罕见病研究的资金支持不足其中的百分之一,相较美国等国家或地区,我国在罕见病基础研究方面的资金投入与其仍有较大差距。
建议参考美国对罕见病自然疾病史研究的资助计划,进一步加大对罕见病基础研究的支持力度,尤其是针对尚无治疗或干预手段的罕见病回顾性或前瞻性的自然史研究,并成立国家罕见病研究项目基金,为疾病研究提供专项的资金支持,不断丰富罕见病药物创新研发全链条的资助格局,鼓励罕见病流行病学、发病机制、基因治疗等项目的研究,加速技术攻关,持续推进罕见病药物的科技创新工作。
3.3 建立罕见病药物临床研究资源共享网络,打通高效的临床研发沟通渠道
由于罕见病发病率低、患者人数少等特点,罕见病患者的临床研究数据也比较匮乏。目前我国通过直报系统收集了超过78万例罕见病患者资料,但仍与我国实际患者数量相差甚远。鉴于我国当前相关罕见病数据信息平台的建设处于起步阶段,建议依托全国罕见病诊疗协作网,建立并完善多元共建共享的罕见病研发信息网络和罕见病药物研发技术平台。
此外,还应打通监管部门和临床研究相关方的沟通渠道。目前我国已经发布《罕见疾病药物临床研发技术指导原则》和《以患者为中心的临床试验实施技术指导原则(试行)》等一系列临床研究指导原则,为罕见病药物的临床研究提供了价值导向,但在政策落实过程中也面临由于信息不对称而导致的非法定罕见病药物的研发指导不明确、项目立项困难及临床评价指标不明晰等一系列问题。因此,可以在现有沟通会议的基础上,拓宽有效的沟通渠道,进一步鼓励申请人与监管机构及时沟通,共同提高罕见病药物临床试验研发的效率和成功率,还可以探索将沟通交流涉及环节进一步前移,例如对有价值的罕见病药物,申请人可以就药物临床前研究阶段中的关键技术问题提出沟通申请,为后续的罕见病药物临床试验研发打下基础。
3.4 聚焦“以患者为中心”,优化罕见病药物审评审批机制
在罕见病药品的审评审批方面,提升审评效率和上市进程,使患者有药可医,对于保障罕见病患者的权益具有重要意义。目前我国已发布3批《临床急需境外新药名单》,对临床急需的罕见病新药开设了绿色通道,并开通了附条件审批渠道,这在一定程度上提高了临床急需罕见病药物的可及性。
但目前我国认定的罕见病治疗药物中,仍至少有27种罕见病药物在我国面临“境外有药,境内无药”的困境。基于此,应进一步加速审评程序,以患者需求为导向,对临床急需罕见病药物的审评审批程序进行提速,形成常态化审批流程。对于开展“先试先行”的罕见病特许药械,在上市审批环节应进一步考虑真实世界数据的证据支持作用。此外,建议我国国家药品监督管理局药品审评中心等统筹部门在审评、咨询、医学、卫生、基本药物等各方面建立相应的专家库,让更多在罕见病领域深耕的专家进入药品审评等环节,并制定出相应的审评标准、规范、要点和方法,凝聚专业力量与资源,建立专业且专门的罕见病药物审评审批通道,提升审评审批效率。
3.5 加速罕见病药物市场独占期落地,优化市场资源配置
对于创新研发企业而言,罕见病药物的盈利情况是影响其研发积极性的重要因素,相关市场独占期和药品专利制度方面的激励政策企业也较为关注。我国药品监管部门于2022年5月发布了《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》,提出对罕见病新药给予最长不超过7年的市场独占期,这与美国在ODA中规定的市场独占期时间一致,但该政策至今仍未落地实施。
建议加快我国市场独占期政策落地和药品专利制度完善,不仅对企业的研发战略规划有引导和激励作用,对罕见病药物研发扎堆导致的市场资源配置不均衡也能起到极好的规范作用,进而可以推动罕见病医药创新和产业良好有序发展。
3.6 完善罕见病多层次保障机制,构建中国特色医疗保障模式
罕见病药物的医保支付政策是医药企业在进行产品研发立项时考虑的重要因素,尤其是对于高值罕见病药物的开发或者引入。我国在基本医疗保障资金有限的条件下,可以做到在一定程度上向罕见病弱势群体倾斜,但将高值罕见病药品全部纳入医保支付体系难以实现。因此,可以依据药物的实际年治疗费用,对部分高值罕见病药物提升准入限额。还可以参考国际高值药品准入管理协议的方式,以支付创新、风险共担等形式解决高值罕见病药物的医保准入问题。
此外,可以基于我国以国家医保为主、商业保险和社会慈善为辅的保障体系,建立由中央政府主导、地方层面根据实际情况自主探索的罕见病医疗保障模式,形成“中央保基本,地方做补充”的保障布局。同时,充分发挥商业健康保险和慈善帮扶的保障作用,参考美国等发达国家或地区商业保险体系的建设经验,通过加强对罕见病产品保障责任的规范统一,鼓励承保企业在罕见病领域布局,加强普惠险对医保目录外罕见病创新药的保障力度。对于公益慈善力量也应给予更多关注,包括患者援助项目的持续稳定运行情况、公益慈善组织的援助资源体量和患者组织的生存状况等,进一步减轻患者的用药负担。
此外,从财政支持方面探索建立国家层面罕见病专项基金,进一步构建由国家医保、商业保险、慈善组织、地方罕见病支持政策以及其他社会主体共同参与、适合我国国情的罕见病多层次保障机制,从保障后端激励罕见病药物的创新研发。
04
结语
罕见病是当今社会关注的热点问题,推进罕见病药物保障也是关系到数以千万计民众切身利益的社会大事。目前我国在罕见病的研发创新上与美国等发达国家或地区仍有较大差距,在罕见病药物研发激励政策的制定上也稍显滞后。我国应借鉴发达国家和地区的政策经验,结合我国国情制定出适用于我国的罕见病认定机制和涵盖药品全生命周期的“1+n”罕见病药物研发激励政策体系,以加快推进罕见病药物创新生态环境建设,促进我国罕见病保障事业不断向前发展。
参考资料:详见《中国新药杂志》2024年第33卷第20期