文献分享丨IF=40.5,跟着高分综述深入学习基因治疗递送载体AAV-概念篇
近期Signal Transduction and Targeted Therapy杂志(IF=40.5)上发表了一篇重量级AAV基因治疗综述文章(通讯作者为美国马萨诸塞大学Chan医学院的高光坪教授),深入探讨了AAV基因治疗的最新突破与未来趋势。这篇文章不仅汇聚了行业内的权威观点,更揭示了关键技术的最新动态,为学术界和产业界的创新提供了全新启发。我们将以系列文章的形式对这篇重量级综述进行分享。

因临床致病性小、多种组织嗜性和长期的转基因表达,腺相关病毒(AAV)已成为临床基因治疗的重要递送工具。重组腺相关病毒(rAAV)是在非致病野生型AAV基础上改造而成的特异性更强的基因载体,已成为一种治疗各种疾病的工具。然而,随着rAAV作为治疗手段的广泛使用,需求的增加为现有的生产工艺带来了挑战。尽管已有八种基于rAAV的基因治疗产品获得了监管机构的批准,但人们仍然对在人类中安全使用高剂量的病毒疗法存在担忧,这些担忧包括免疫反应和不良反应,如基因毒性、肝毒性、血栓性微血管病和神经毒性。
基因治疗是一种开创性的疾病治疗方法,通过采用非病毒或病毒载体在目标细胞内修改基因表达的一系列策略来治疗遗传疾病。一种常见的策略是基因替代疗法,即向活细胞引入有缺陷基因的功能拷贝。2017年,这一策略达到了一个重要的里程碑,美国食品药品监督管理局(FDA)批准了首个基因治疗产品Luxturna,这是一种用于治疗Leber先天性黑蒙症2型(LCA2)的基因替代疗法。另外,基因沉默疗法旨在抑制或沉默目标基因,主要是通过RNA干扰。例如,Patisiran,一种小干扰RNA,用于治疗遗传性转甲状腺素淀粉样变性。另一种策略是基因组编辑,通过基于簇状规则间隔短回文重复序列(CRISPR)的技术来直接修改体细胞基因组,或者进行RNA编辑。此外,基因表达还可以通过DNA甲基化、组蛋白修饰和微小RNA调控等表观遗传方法来改变。这种方法具有可逆和多功能的优势,允许根据疾病进展和治疗反应进行调整。创新策略,如利用抑制性tRNAs来实现过早终止密码子的读通,为挽救病理性无义突变并恢复基因功能提供了途径,且可以在内源性调控下实现。
无论选择哪种策略,基因治疗都可以在体外或体内实施。体外基因治疗涉及提取患者的细胞,对其进行遗传修饰,然后将它们重新回输至患者体内。相比之下,体内基因治疗直接将遗传物质递送到目标组织。到目前为止,总共有14种体外和29种体内基因治疗获得了FDA批准(图1)。在这些获批的基因治疗中,17种是基于非病毒的,而26种是基于病毒的。已报道有多种病毒载体可用于体内基因治疗,包括腺相关病毒(AAV)、腺病毒(Ad)、逆转录病毒、慢病毒和单纯疱疹病毒(HSV)等,其中AAV载体已成为临床试验和FDA批准应用中的首选。这是因为它们具有广泛的组织嗜性、相对良好的安全性和多样化的制造工艺。重要的是,AAV是非致病性的,很少整合到宿主基因组中,并且可以维持长期的转基因表达。此外,基于某些AAV血清型的载体天然能够高效地进入细胞和表达转基因,这增强了转导效率。
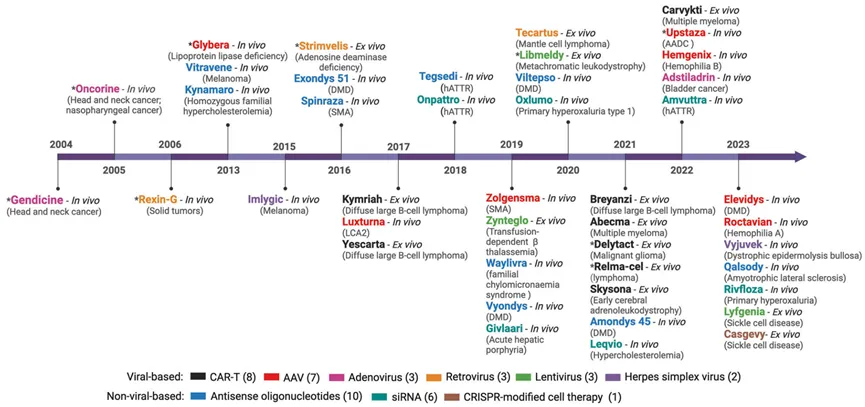
图1 获批的基因治疗产品和递送平台。基因治疗产品通常针对以下两种情况开发:(1)体外基因治疗,即分离受影响的患者细胞,在细胞培养过程中进行基因修饰、扩增、富集,然后重新输回患者体内,作为活体药物发挥作用(例如,CAR-T细胞、Lyfgenia、Casgevy);(2)体内基因治疗,直接给患者施用以实现治疗效果(例如,Gendicine、Kynamaro、Imlygic、Luxturna、Onpattro)。基因治疗药物的递送平台主要分为两种:基于病毒和非病毒的。基于病毒的基因治疗利用病毒作为基因递送载体,包括AAV(腺相关病毒)、腺病毒、逆转录病毒、慢病毒和单纯疱疹病毒。基于非病毒的基因治疗包括反义寡核苷酸、siRNA(小干扰RNA)和基于细胞的CRISPR基因组编辑。CAR-T(嵌合抗原受体T细胞治疗),SMA(脊髓性肌肉萎缩症),AADC(芳香族L-氨基酸脱羧酶缺乏症),DMD(杜氏肌营养不良症),LCA2(Leber先天性黑蒙症2型),hATTR(遗传性转甲状腺素淀粉样变性)。*表示非FDA批准的基因治疗。
在20世纪60年代中期,AAV首次被发现,最初被当作是腺病毒培养中的污染物。野生型腺相关病毒(wtAAV)是一种无包膜病毒,含有一个单链DNA(ssDNA)基因组,在两端都有反向末端重复序列(ITRs)(图2)。对AAV生物学的研究导致了wtAAV2基因组的成功克隆和测序。在1990年代和2000年代,鉴定出具有不同组织趋向性的多种AAV血清型,从而引入了靶向基因递送方法的途径。研究报告称,wtAAV基因组可以整合到宿主染色体中,促进稳定、长期的转基因表达。在2000年代,开展了工程化AAV衣壳的工作,以增强组织特异性和转导效率,提高rAAV的安全性,这促进了基于rAAV的临床试验的成功,尤其是对于单基因罕见病,最终导致rAAV基因治疗产品的获批。同时,开发了各种扩大rAAV制造规模的方法,引发了对基于rAAV的基因治疗的兴趣。最近,CRISPR技术的出现彻底改变了基因治疗的格局,通过rAAV的递送可实现精准的基因编辑。
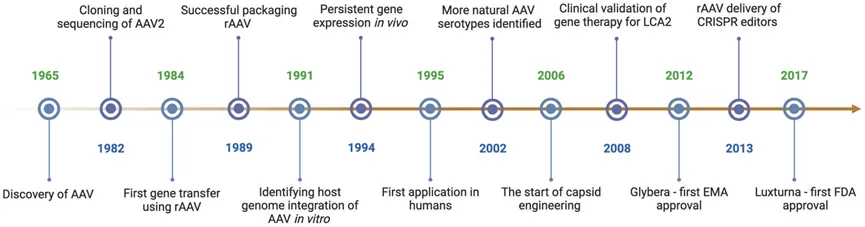
图2 腺相关病毒(AAV)生物学研究和基因治疗发展的历史里程碑。几十年来对AAV生物学的研究导致了对其结构、生物学、载体学和基因治疗应用的理解上的关键进展。这些进展为基于rAAV的基因治疗成功进行临床试验和获得监管批准铺平了道路。
rAAV独特的属性,包括小尺寸、非致病性、多种组织嗜性、稳定的转基因表达、复制缺陷、可工程化的衣壳,以及适配多种载荷递送的能力,使得基于rAAV的基因治疗成为了一度无法治疗的遗传性疾病的潜在治疗方法。尽管早期取得了一些成功,但众多的顾虑和挑战限制了其在复杂疾病中的广泛应用。这些顾虑和挑战包括有限的载体容量、对高剂量系统给药的免疫反应、潜在的基因毒性、实现组织特异性的挑战,以及制造的复杂性。在这里,我们描述了作为rAAV基因治疗基础的AAV生物学和工程学,讨论了AAV载体学的关键原则和当前的制造方法,概述了rAAV基因治疗在治疗多种人类疾病方面的临床应用和挑战。
结构和基因组。AAV具有由60个单体组成的二十面体衣壳和一个4.7 kb的单链DNA(ssDNA)基因组,两端各有145 bp的T形反向末端重复序列(ITR)(图3)。衣壳由病毒蛋白(VPs)VP1、VP2和VP3以1:1:10的比例组装而成。VP3由保守的β-链组成,这些链通过表面暴露的可变环连接。这些结构塑造了AAV的表面形态,并决定了AAV血清型特异性功能。野生型AAV基因组包含两个主要的开放阅读框,编码四个非结构复制基因(Rep)和三个结构衣壳基因(Cap),以及一个参与衣壳组装的组装激活蛋白(Assembly-Activating Protein, AAP)。此外,膜相关辅助蛋白(MAAP)的编码框在Cap基因不同阅读框内,其功能尚不清楚。ITRs主要作为病毒复制的起点,并提供包装信号。
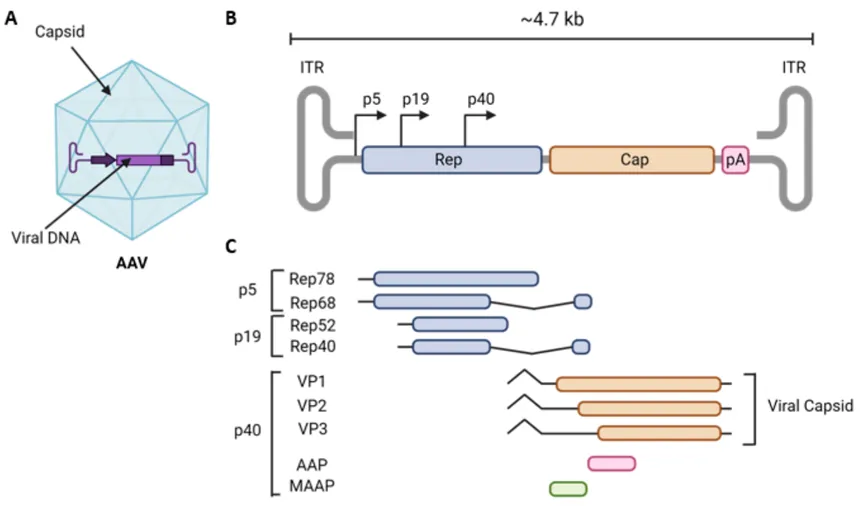
图3 野生型AAV的基因组结构特征示意图。ITR: inverted terminal repeat, 145bp, AAV基因组复制、宿主细胞染色体整合和AAV病毒包装的顺式信号; Rep: 反式调节因子,调节AAV基因组复制、宿主细胞染色体整合;CAP: 组成病毒衣壳的蛋白,三种结构蛋白由不同的翻译起始位点形成; p5, p19是调控Rep蛋白表达的启动子,p40是调控Cap蛋白表达的启动子; AAP: AAV accessory protein, 组装激活蛋白;MAAP: membrane-associate protein, 膜相关辅助蛋白。
血清流行率和非致病性。不同的野生型AAV血清型主要分离自人类和非人灵长类动物(NHPs),以VPs和ITRs的变化为特征。人类血清流行病学研究表明,相当一部分人群拥有针对多种AAV血清型的中和抗体(NAbs)。一项对888份健康志愿者的人类血清样本的研究发现,针对AAV2的NAbs最为普遍,其次是AAV1、AAV7和AAV8。另一项研究显示,在552份人类血清样本中,除AAV2之外,针对最普遍的血清型NAbs是AAV1(74.9%)、AAV6(70.1%)、AAV5(63.9%)、AAV8(60.4%)和AAV9(57.8%)。
作为细小病毒科(Parvoviridae)中的依赖性细小病毒(Dependoparvovirus),wtAAV不能独立复制并产生新的病毒颗粒,其复制需要来自辅助病毒(如腺病毒或单纯疱疹病毒)的必须基因,例如腺病毒的E1、E2a、E4和VA RNA基因。值得注意的是,在体外感染中,大约0.1%的野生型AAV2基因组整合到19号染色体长臂上的一个特定区域(19q13-qter),这个区域被称为AAVS1位点。虽然AAV被认为是非致病性的,但最近的研究报道AAV2与全球儿童中未解释的急性肝炎有关。没有直接证据表明AAV2如何引发肝炎,但已提出对AAV2的异常免疫反应可能导致肝毒性。然而,这些研究承认COVID-19感染可能是一个促成因素,并报告称大多数急性肝炎病例在没有长期免疫抑制的情况下得到了解决。
作为基因治疗递送载体的rAAV
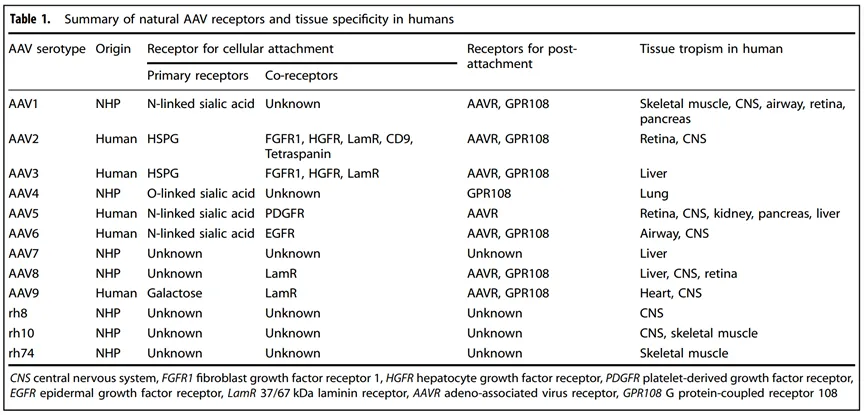
载体学和组织嗜性。自然存在的野生型AAV正在迅速进化,产生了广泛的基因多样性。在过去的二十年中,至少从腺病毒库、人类/非人灵长类动物组织以及其他哺乳动物或非哺乳动物物种中鉴定出了12种AAV血清型和超过1000种变体。这些血清型对各种细胞或组织有不同的偏好,被称为嗜性(表1)。AAV血清型之间的基因组差异主要位于病毒衣壳序列的可变区域,特别是VP3,它在决定嗜性方面起着至关重要的作用。然而,许多其它过程和与宿主蛋白的相互作用可能会影响嗜性,包括细胞表面受体、细胞内摄取、细胞内运输、入核、病毒脱壳、第二链DNA合成以及基因组的环化和串联化。
野生型AAV2基因组最初在20世纪80年代被克隆,是rAAV的模板。rAAV拥有与wtAAV相同的衣壳序列和结构,但不包含任何wtAAV蛋白编码序列,而是整合了治疗性基因表达盒,这些表达盒的大小位于4.7 kb的包装能力范围内。rAAV基因组中唯一的病毒元素是ITRs。rAAV主要是通过在HEK293细胞中瞬转GOI质粒、Rep/Cap质粒和腺病毒辅助基因质粒来生产的(图4)。具有AAV2 ITRs的rAAV基因组可以用其它AAV血清型的衣壳包装,以改变它们的转导特性。
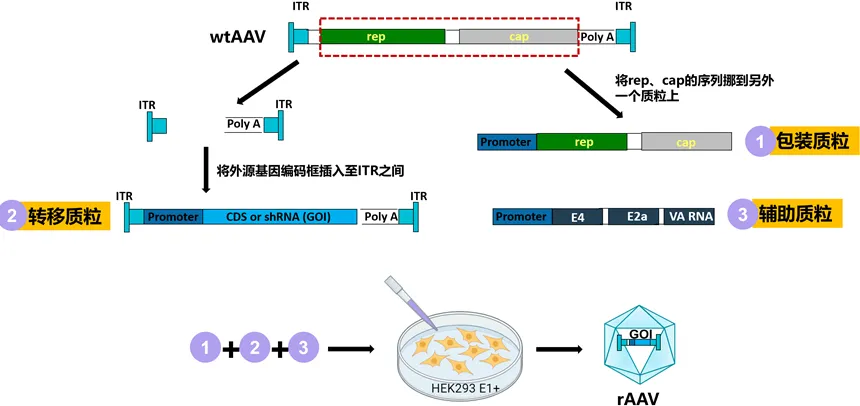
图4 rAAV的生产过程示意图。
rAAV的转导途径。虽然对野生型AAV生物学的理解有所提高,但rAAV如何与细胞表面相互作用并将外源基因递送到宿主细胞核的机制仍然不甚清楚。越来越多的研究表明,病毒衣壳最初通过主要受体如糖链、糖缀合物或唾液酸粘附到细胞表面,然后与共受体蛋白相互作用。例如,rAAV2与肝素硫酸蛋白多糖(HSPG)结合,rAAV1、rAAV4和rAAV5主要与唾液酸相互作用,而rAAV9与N-连接的半乳糖相互作用。衣壳上不同的结合位点被认为决定了其嗜性,因此正在围绕这些位点努力改造AAV变体,以增强对特定细胞或组织的转导能力。近期的全基因组筛选研究鉴定了促进rAAV转导的新宿主蛋白,包括被命名为AAV受体(AAVR)的I型跨膜蛋白KIAA0319L。另一种普遍存在的宿主蛋白,G蛋白偶联受体108(GPR108),在多种rAAV血清型的转导中发挥作用。虽然在体内敲除AAVR和GPR108会减少转导,但细胞表面结合大部分不受影响,这表明这些宿主蛋白主要在附着后对转导过程有所贡献。
在与细胞表面结合后,rAAV通过内吞作用内化(图5),这一过程可能因细胞类型和rAAV血清型而异。在内体中的rAAV颗粒会经历pH依赖的构象变化,然后通过高尔基体网络进行转运。rAAV颗粒从内体和高尔基体网络中逃逸,然后通过核孔复合体进入细胞核。一旦病毒颗粒进入细胞核,ssDNA基因组被释放,并通过所谓的第二链合成过程转化为双链DNA(dsDNA)。然后从基因组3'端的自启动ITR开始启动转录。通过突变内部ITR基序,可以将基因组制成dsDNA结构,与单链rAAV(ssAAV)基因组相比,这种设计复制速度更快,转导效率更高。然而,这种自互补AAV(scAAV)的包装能力只有ssAAV的一半。dsDNA基因组随后经历环化和串联化,稳定了载体基因组,使其在有丝分裂后细胞中以质粒形式持续存在。值得注意的是,ITR序列也可以作为重组元件,促进载体基因组的重组。rAAV转导途径涉及多个细胞事件,可能在任何步骤失败或被宿主破坏,从而削弱或阻止转导。因此,完全理解这一途径将有助于识别影响rAAV转导效率的其他关键宿主因子。
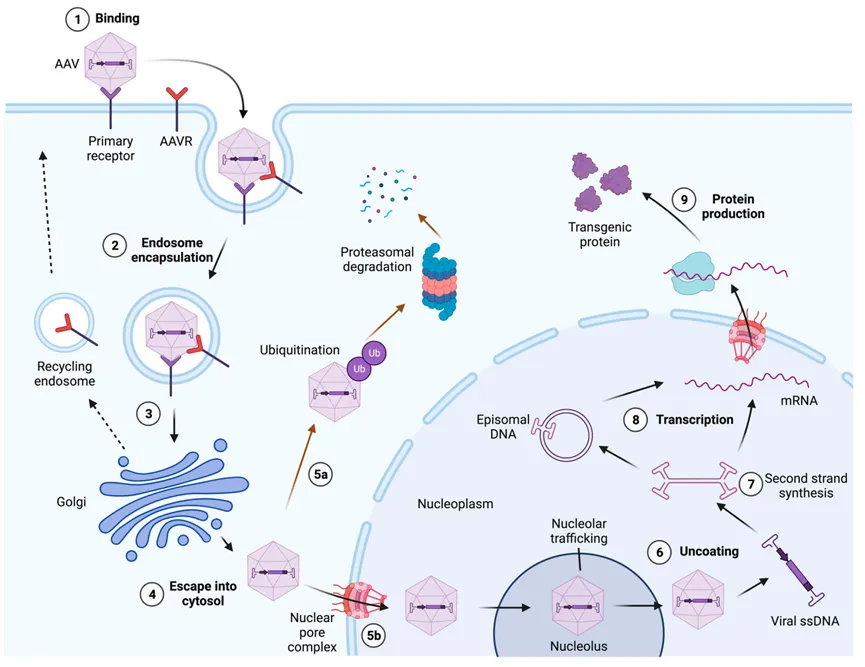
图5 AAV载体入侵细胞和细胞内运输的模型。在与受体和辅助受体的相互作用下,以及在必需的宿主细胞组分(如AAV受体,1)的帮助下,AAV通过内吞作用(2)进入目标细胞,并在一个内吞囊泡内通过逆行运输向高尔基体网络移动(3)。内吞体的酸化以及可能的其他因素触发衣壳内的重大结构变化,暴露出一个磷脂酶A2(PLA2)催化域,允许病毒颗粒逃逸到细胞质中(4)。然后AAV病毒颗粒可以被泛素化以进行降解(5a),或者通过核孔复合体被导入到细胞核中(5b)。在细胞核中,它先在核仁中积累,然后移动到核质中,在那里释放单链基因组(6),并转换成可以在细胞核中以环形游离体或线性或游离体连接体的形式持久存在的双链DNA(7),从而引起基因表达(8)和蛋白质合成(9)。
基因治疗作为一种革命性的治疗手段,对多种遗传性疾病有着强大潜力。从最初的AAV发现,到rAAV载体的设计和优化,再到其在临床试验中的广泛应用,这一领域已经取得了显著进展。然而,rAAV基因治疗仍面临诸多挑战。本文简要介绍了AAV的基本概念。后续我们将持续推出关于rAAV基因治疗的深度剖析文章,带您深入探索这一领域的奥秘与挑战,敬请关注!
参考资料:
1. https://doi.org/10.3390/v16030442
2. https://doi.org/10.1038/s41392-024-01780-w