Nature:神经退行性疾病新型治疗靶点——NPTX2
TDP-43(TAR DNA binding protein-43,TAR DNA 结合蛋白 43)是一种多功能的 DNA 和 RNA 结合蛋白,其在正常生理状态下能够参与到包括 RNA 代谢调节、蛋白质质量控制系统和线粒体质量控制系统等多项功能之中。
近年以来,不断有研究证实神经退行性疾病,如肌萎缩侧索硬化症(ALS)、额颞叶变性(FTLD)和阿尔茨海默病(AD)等与 TDP-43 蛋白相关,然而这些疾病背后的致病机制与 TDP-43 蛋白之间的关联并不明确。
对此,来自苏黎世大学等机构的一组研究人员利用神经细胞培养模型,揭示了上述神经退行性疾病背后所涉及的神经变性机制。研究结果表明,这两种疾病中的神经元病变与一种名为 NPTX2 的蛋白质过量相关,而这一现象是由 TDP-43 功能障碍所引发。
在此之后,研究者通过进一步试验表明,通过降低 NPTX2 水平有助于改善神经退行性病变。该结果或将为 ALS 和 FTLD 的相关药物研发铺平道路。
图1:文献截图,来源:Nature
目前,论文 A model of human neural networks reveals NPTX2 pathology in ALS and FTLD 已发表于 Nature 期刊。
源于 iPSC,开发稳定性、灵活性兼备的神经模型 iNet
本次研究中,研究人员创建了一种新型神经细胞培养模型 iNet,其源自于人类诱导多能干细胞(iPSC)。研究者指出,首先利用人类诱导多能干细胞生成自我更新的人类神经干细胞系(iCoMoNSC)。随着培养中 iCoMoNSC 衍生神经元的成熟度不断增加,分化的 iCoMoNSC 形成了一个自组织的多细胞系统,其被命名为 iNet。
根据 scRNA-seq 数据,该神经模型中包含了转录成熟、与脑类器官相似的神经元和神经胶质细胞。尽管源细胞存在差异,并且没有 3D 器官样细胞组织,但 iNet 中的神经元和神经胶质基因表达与大脑皮质类器官中的细胞相似。
据研究人员介绍,iNet 模型培养物的寿命可以持续长达一年,并且易于复制,这些特性使其能够用于研究神经元随时间衰退的相关机制。
该论文的第一作者、来自苏黎世大学定量生物医学系的博士后研究员 Marian Hruska-Plochan 表示,“老化 iNet 的稳健性使我们能够进行许多原本无法开展的实验。而且该模型的灵活性也使其适用于广泛的实验方法。”
论文的通讯作者、来自苏黎世大学的定量生物医学系生物医学教授 Magdalini Polymenidou 则强调,相对于类器官,iNet 更容易进行操作、克隆和成像,并且该方法能够将类器官的类脑特征与 iPSC 衍生单一培养物的灵活特性结合起来。
接下来,研究人员使用其模拟 FTLD 患者细胞中的 TDP-43 病理变化。此前已有研究表明,在 FTLD 患者的死后样本中,只有约 2% 的皮质神经元表现出 TDP-43 相关病理迹象。为了模拟这一点,研究人员使用低滴度的慢病毒载体转导年轻的 iNet 培养物,该慢病毒载体中携带标记野生型 TDP-43。而在表达的前三周内,一半的转导细胞死亡。
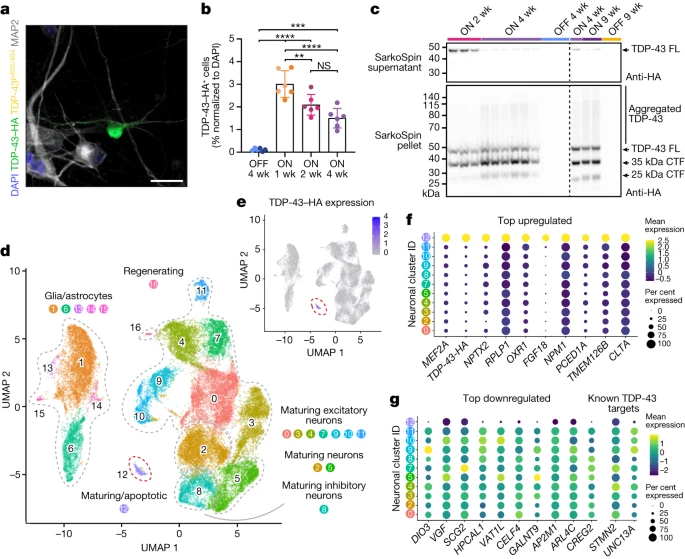
图2:诱导 TDP-43 病理的 iNet 神经元转录谱,来源:Nature
针对于 iNet 裂解物的分析结果显示,随着时间的推移,标记的 TDP-43 逐渐产生聚集,类似于 TDP-43 蛋白相关疾病中所发生的的情况。尽管如此,在转导的细胞中却看不到任何内含物。相反,在邻近的非转导神经元中却出现了小的点状内含物。这些斑点逐渐长成更大的沉积物,从而影响神经元过程。
对于造成这一现象的原因,研究人员目前尚未形成统一结论。但 Polymenidou 推测,当受 TDP-43 过度表达影响的神经元开始死亡时,邻近的神经元可能会吸收碎片,其中就包括 TDP-43 聚集体。另一种情况可能是,来自受转导神经元的信号会以某种方式引发其他细胞内的 TDP-43 病理。
降低 NPTX2 水平可改善神经退行性病变
那么,TDP-43 过剩与 NPTX2 转录上调又有何关联?研究者发现,在生理条件下,TDP-43 能够直接与 NPTX2 的 mRNA 结合。而在 FTLD 患者的大脑中,这种 TDP-43-NPTX2 相互作用急剧减少。
从本次研究的 RNA 测序数据来看,研究者指出,由于 TDP-43 结合在不溶性团块中,因此 NPTX2 的翻译不受控制。
由此引发的后果是,当 NPTX2 在 iNet 中过表达时,其表现出神经毒性,而通过纠正 NPTX2 失调可以部分地挽救由 TDP-43 诱导以致变性的神经元。
特别值得注意的是,研究证实 NPTX2 在具有 TDP-43 病理学的肌萎缩性侧索硬化症和额颞叶变性患者的神经元中持续积累。因此,研究者直接将 TDP-43 失调和 NPTX2 积累联系起来,从而揭示了 TDP-43 依赖性神经毒性途径。
在此之后,研究团队利用 iNet 模型开展了一项额外的实验,以测试 NPTX2 是否能够用于 FTLD 和 ALS 的药物设计靶标。
图3:通过纠正 NPTX2 的毒性水平改善 TDP-43 诱导的神经变性,来源:Nature
该团队设计了针对于 NPTX2 的 shRNA ,利于其在 TDP-43 蛋白过表达的 iNet 模型中进行测试。结果显示,通过降低 NPTX2 水平可以部分地改善 iNet 神经元中已经发生的神经退行性病变。由此推测,用于靶向和减少 NPTX2 蛋白的药物或能够阻止 ALS 和 FTLD 患者的神经退行性病变。
总体而言,该项工作确定了异常的 NPTX2 积累是神经系统疾病中 TDP-43 失调的直接后果,揭示了与 TDP-43 蛋白相关疾病的新的神经毒性途径,并为改善 NPTX2 水平相关的治疗策略提供了证据。
对于本次研究,Polymenidou 总结认为,“在将其带给患者之前,我们还有很长的路要走,但 NPTX2 的发现让我们有机会能够开发一种针对疾病核心的治疗方法。与此同时,考虑到其他研究团队新近确定的其他靶点,可以想象,抗 NPTX2 药物未来可能会成为 ALS 和 FTLD 疗法的关键组成部分。”
论文链接:https://www.nature.com/articles/s41586-024-07042-7
来源:生辉
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。