Nature Reviews Drug Discovery :张锋最新综述论文系统总结基于CRISPR的基因编辑工具及其递送载体
基于CRISPR的药物理论上可以操纵任何基因靶点。然而,在实践中,这些药物必须进入预期的细胞而不引起不必要的免疫反应,因此,它们通常需要一个递送系统。
近日,张锋、Victoria Madigan、James Dahlman在 Nature 旗下综述期刊 Nature Reviews Drug Discovery 上发表了题为:Drug delivery systems for CRISPR-based genome editors 的综述论文。
在这篇综述论文中,张锋等人回顾了基于CRISPR的基因组编辑器的药物递送系统,重点关注腺相关病毒(AAV)和脂质纳米颗粒(LNP)。在描述了这些药物递送系统的设计以及它们在临床前动物模型中的后续表征之后,还强调了来自最近临床试验的数据。此外,该综述还讨论了由聚合物、蛋白质(包括病毒样颗粒)和其他载体介导的CRISPR系统的临床前靶向研究。

图1 来源于Nature官网
来源于原核生物的CRISPR-Cas系统已被设计用于操纵人类细胞中的目标DNA或RNA序列的基因编辑工具。这些系统使用互补的向导RNA(gRNA)来寻找目标序列,它们几乎可以针对任何遗传背景进行重编程,因此,迅速成为了解基因如何影响细胞行为的研究工具。更重要的是,这些系统在治疗遗传疾病方面潜力巨大,目前已有几种基于CRISPR的药物正在进行临床试验。这些试验数据提供了早期证据,表明可以对人类进行靶向基因组编辑来治疗疾病。为了实现基因组编辑器的体内治疗潜力,它们必须在不引发不必要的免疫反应的情况下被递送到所需的细胞。基于病毒载体的递送系统以及非病毒递送系统已被用于实现体内CRISPR递送;在这些递送系统中,腺相关病毒(AAV)和脂质纳米颗粒(LNP)是临床上最先进的。例如,现在已有临床试验使用AAV递送基因编辑器治疗Leber先天性黑蒙10型(LCA10)和艾滋病患者,使用LNP递送基因编辑器治疗转甲状腺素蛋白淀粉样变性(ATTR)、遗传性血管性水肿(HAE)和杂合子家族性高胆固醇血症(HFH)。这篇综述论文讨论了基于CRISPR的基因组编辑器的递送系统,重点关注AAV和LNP,对于它们作为递送系统的优缺点,如何在动物模型中用于递送基于CRISPR的疗法,它们在正在进行的临床试验中的应用,以及可用的安全性和有效性读数都进行了详细介绍。此外,还评估了体内递送CRISPR-Cas有效载荷的替代和新兴递送系统,这些系统可能在未来的临床研究中具有应用价值。
#成熟的和新型的基因编辑器
CRISPR-Cas系统是一种广泛用于抵御入侵噬菌体和外来遗传物质的原核生物的防御系统。本质上,它们由效应器模块和适应模块组成,在1型CRISPR系统中,效应器是蛋白质复合物,而在2类CRISPR系统中,则是单一效应器,其通过CRISPR RNA(crRNA)定向并切割入侵的核酸。适应模块负责将入侵的外来核酸序列整合到CRISPR阵列中,并从中表达出crRNA。由于这些系统是RNA引导的,因此可以通过改变crRNA的序列来重新定向,为可编程基因组编辑工具提供了起点。
CRISPR-Cas9
第一个被设计用于人类细胞基因编辑的是属于2型CRISPR系统的CRISPR-Cas9,来自化脓链球菌,也是现在最广泛使用的CRISPR基因编辑器。Cas9在gRNA的引导下在目标位点上产生DNA双链断(DSB);在人类细胞中,这些DSB可以通过非同源末端连接(NHEJ)进行修复,这一过程通常会导致基因功能丧失。早期临床数据表明,NHEJ介导的基因敲除减少了致病蛋白的表达。此外,靶向DSB也可以通过宿主细胞的内源性同源修复(HD)机制进行修复,从而通过提供外源模板DNA,进行基因敲入和整合。
Cas9出了用于基因敲除和基因敲入外,还可以对其进行修饰以实现其他基因调控的效果。例如,通过突变Cas9蛋白产生dCas9,只保留其作为DNA结合蛋白的功能,可以与转录激活蛋白(例如VP64)结合以激活基因表达,可以与转录抑制因子(例如KRAB)结合以抑制基因表达,还可以与表观基因组修饰因子(例如DNA甲基化酶DNMT3A、去甲基化酶TET1)结合,进行表观遗传调控。
碱基编辑和先导编辑
通过突变Cas9的催化核酸酶结构域之一,可以产生只切割目标DNA链或只切割非目标DNA链的切割酶。dCas或Cas9切口酶(nCas9)与胞嘧啶脱氨酶或腺嘌呤脱氨酶的融合,导致了一种新的基因编辑器——碱基编辑器(Base Editor,BE)。这种编辑器不依赖DNA双链断裂(DSB),可实现单个碱基之间的转换。
碱基编辑器的开创者刘如谦教授还开发了先导编辑器(Prime Edito,PE),先导编辑器通过将Cas9切口酶(nCas9)与工程化逆转录酶(RT)融合,在PE gRNA(pegRNA)引导下,不依赖DNA双链断裂(DSB),而且无需供体DNA模板便可有效实现所有12种单碱基的自由转换,而且还能有效实现多碱基的精准插入与删除。该工具“原则上可以修复75000种已知致病性人类遗传变异的89%”。
刘如谦团队还进一步开发了双先导编辑(Twin Prime Editing,TwinPE)。TwinPE同样不会导致DNA双链断裂,通过一个先导编辑蛋白和两个pegRNA,实现对人类基因组的可编程的大片段DNA的删除、替换、整合和倒位,为治疗复杂人类遗传疾病或大型基因突变所致的人类遗传疾病提供了有效工具。
而最近,麻省理工学院的 Omar Abudayyeh、Jonathan Gootenberg 等人在CRISPR的基础上开发了一种名为PASTE的新技术,能够以更安全、更有效的方式替换突变基因,可向哺乳动物及人类细胞中定点插入长达36000个碱基的DNA长片段。
其他CRISPR系统
在开发用于基因组编辑的来自化脓链球菌的SpCas9的同时,许多其他CRISPR系统也被设计用于人类细胞。这些系统包括其他Cas9同源物——例如来自金黄色葡萄球菌的SaCas9、来自脑膜炎奈瑟菌的NmeCas9,以及其他DNA内切酶(例如Cas12)和RNA内切酶(例如Cas13);而RNA内切酶构成了REPAIR和RESCUE这两个转录组编辑平台的基础。这些技术共同构成了大量用于治疗各种人类疾病的工具。每种技术都有其自身的优势,在特定情况下可能有益,但它们都有一个共同点:为了实现其巨大的治疗潜力,它们必须有效和安全地被输送到人体的正确位置。
#递送载体
Cas酶的设计以两种看似不同的方式影响着递送系统的选择。首先,设计决定了酶应该表达多长时间。在理想的基于DNA编辑器的治疗中,酶将被瞬时表达,因为NHEJ、碱基编辑或基因插入的作用是永久性的,即使在快速分裂的细胞中也是如此。相比之下,在基于RNA核酸酶的治疗中,酶将被表达更长的时间,因为产生的变化不是永久性的。第二,递送系统的选择受到Cas酶或组件大小的影响。添加一个导致激活、表观遗传变化、碱基编辑或基因插入的结构域会增加有效载荷的大小。
纳米颗粒已经递送了大型组件,包括基于dCas9的表观基因组编辑器和自扩增RNA,其长度可达10kb。然而,更长的mRNA更有可能含有杂质,包括双链产物,这可能会增加炎症水平,从而阻断蛋白质的产生。LNP可能形成不含任何RNA的空囊泡,在这种情况下,较大的mRNA可能会产生更高的空囊泡百分比。而当使用AAV递送CRISPR系统时,有效载荷的大小甚至更重要,AAV递送系统已经在临床中广泛使用,但其递送大小的限制仅为4.7kb。
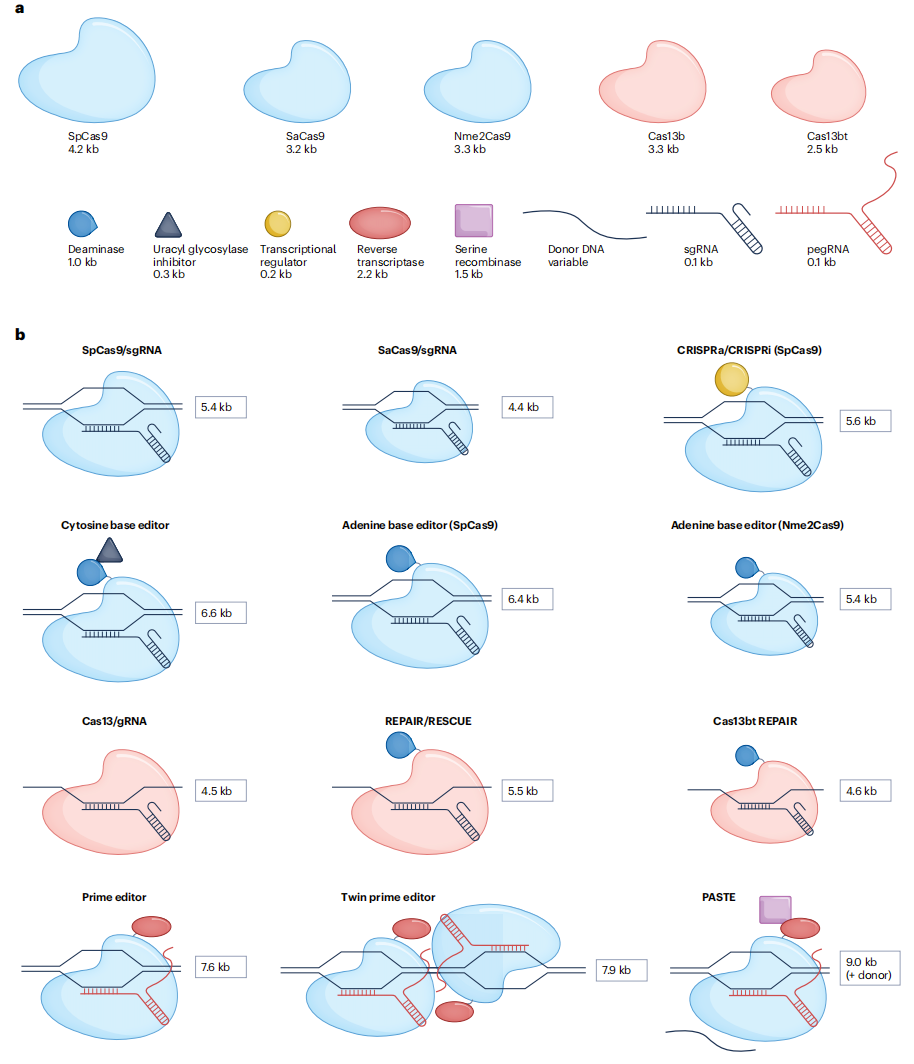
图2:常用的基因编辑工具的尺寸
AAV递送载体
腺相关病毒(AAV)是一类天然非致病性病毒,其基因组是一段长4.7kb长的单链DNA,其中包含两个具有良好特征的开放阅读框:Rep和Cap。AAV是目前最广泛应用的体内基因治疗递送载体,目前已有几款AAV基因疗法获批上市,还有数百项AAV疗法正在进行临床试验。
优化Cas组件尺寸用于AAV递送
AAV递送系统可以包装和递送任何小于4.7kb的基因片段。而较长的基因片段会导致低载体产量和无效包装。通过工程化调控元件,包括启动子、增强子和聚腺苷酸化信号,既可以减少这些元件的大小,又可以将基因表达限制在所需的组织或细胞类型中。为了进一步克服上述递送限制,科学家们试图分离出更小的、但仍能产生治疗效果的蛋白质。例如,编码肌营养不良蛋白的基因非常巨大,而通过去除其中部分外显子所构建的微型化肌营养不良蛋白,通过AAV递送,在临床试验中显示出了对杜氏肌营养不良(DMD)的治疗效果。
此外,还可以通过识别自然界中更小的Cas酶,从而使其符合AAV的4.7kb的包装限制。例如,来自金黄色葡萄球菌的SaCas9,相比来自化脓链球菌的SpCas9短1kb以上,可以与gRNA一起被单个AAV载体中。以及后续发现的Nme2Cas9、Cas12f、Cas12j、Cas13b、Cas13bt等等。
考虑到Cas系统的多样性,即使在添加额外的结构域后,也可能继续发现小到足以装入单个AAV内的Cas酶。但还存在第二种方法来规避AAV4.7kb的包装限制——将有效载荷分成两个部分,并将两个AAV转入同一细胞。这个目标可以通过使用部分重叠AAV载体、反式剪接载体和断裂内含子来实现。这一策略的灵感来自于对AAV载体基因组大小上限进行研究的结果。但这种方法的转导效率显著低于单个AAV载体。
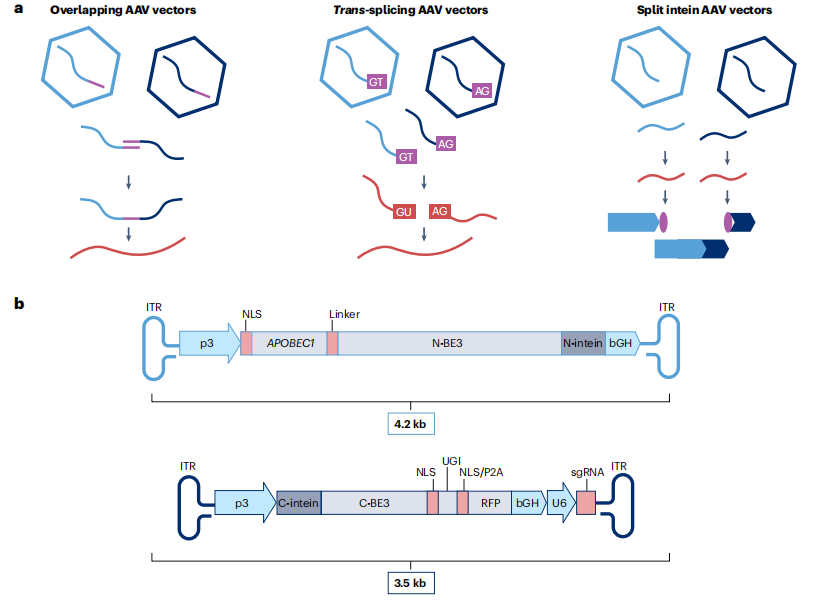
图3:断裂AAV载体的设计
工程AAV的趋向性
之前的基础研究确定了天然AAV血清型,它们具有着不同的趋向性,这也是工程化AAV的基础,可以通过去除或改变AAV衣壳表面的受体结合基序理性设计AAV的趋向性。此外,外源性细胞靶向肽或纳米体的合理插入,也产生了具有良好转导特性的新型AAV。为了设计具有改进靶向性的AAV衣壳,通常创建不同衣壳的文库,然后在体内同时进行测试。
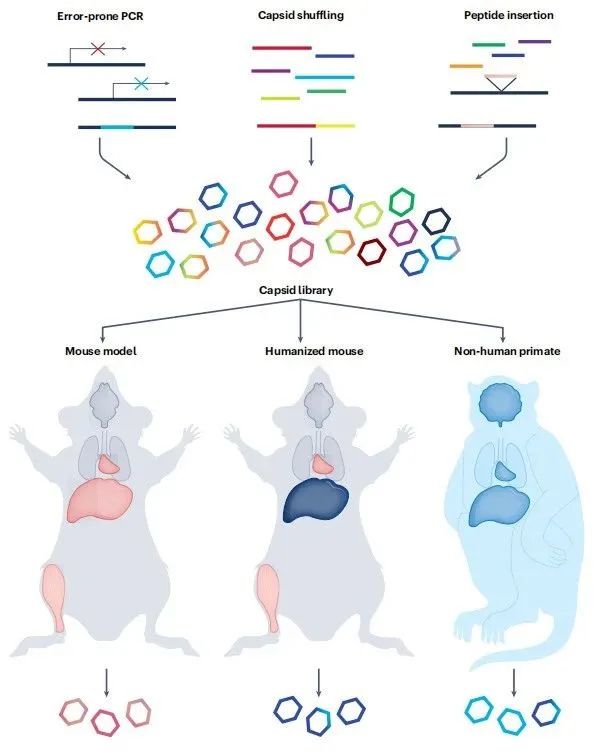
图4:AAV衣壳文库的构,以及在体内筛选递送能力增强的衣壳
AAV基因替代的临床试验可以为CRISPR疗法提供信息
设计CRISPR有效载荷和传递它的AAV衣壳的能力是迈向临床转化的重要一步。而CRISPR临床试验的设计以及研究公司和FDA之间的互动可能会受到正在进行的使用AAV进行的基因替代疗法的临床试验的影响。
例如,FDA最近发表的一篇关于AAV临床试验结果的综述显示,在800例接受Zolgensma疗法(诺华公司开发的基于AAV9的治疗脊髓性肌萎缩症的基因疗法)的患者中,三分之一报告了肝毒性,包括血清转氨酶水平高达正常范围上限的20倍。欧洲药品管理局随后向临床医生发布了关于使用该药物治疗患者肝损伤的指南。鉴于Zolgensma有效地治疗了一种致命遗传疾病,患者可能能够耐受这些副作用。但这一结论可能不适用于一些轻度疾病。
AAV介导的CRISPR治疗
虽然大多数在临床试验中测试的基于AAV的药物是基因替代疗法,但基于AAV的CRISPR疗法也已开始进入到人体临床试验。
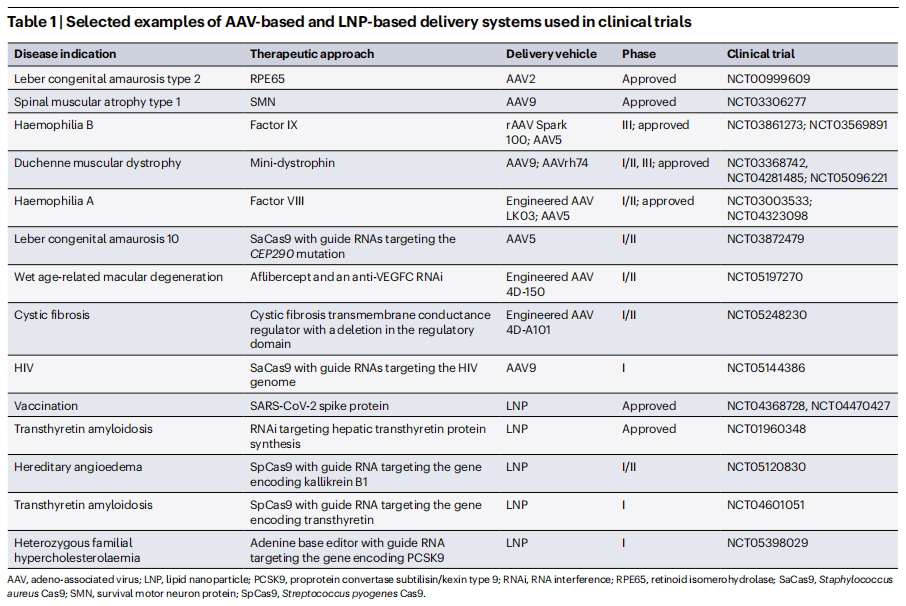
图5:基于AAV和LNP的递送系统在临床试验中的应用案例
例如,Editas Medicine公司开发的EDIT-101疗法,旨在治疗遗传性的Leber先天性黑蒙10型(LCA10),这是一种由CEP290基因功能缺失突变引起的常染色体隐性遗传疾病。LCA10最常见的原因是内含子点突变,导致转录过程中的异常剪接。EDIT-101疗法通过将编码SaCas9和两个gRNA的AAV5注射到眼睛,删除包含点突变的内含子。临床试验结果显示,EDIT-101的耐受性良好,未导致剂量限制性毒性、药物相关严重不良事件或眼部严重不良事件。在14例接受治疗的患者中,2例纯合突变患者对治疗有反应,而12例杂合突变患者中仅1例有反应。这些数据表明,携带纯合IVS26突变的患者可能代表一个遗传学定义的亚群,该亚群可能从该治疗中受益。值得一提的是,2022年10月,一位名叫 Terry Horgan 的27岁杜氏肌营养不良症(DMD)患者在接受重组腺相关病毒9型(rAAV9)载体递送的CRISPR基因编辑治疗后不幸去世。2023年9月28日,麻省大学医学院和耶鲁大学的研究人员在《新英格兰医学杂志》(NEJM)上发表的研究论文显示,Terry Horgan 在接受治疗后第6天出现急性失代偿性心衰并持续心脏骤停,并在2天后死亡。研究团队对他的死亡原因进行了深入分析,尸检结果显示了严重的急性呼吸窘迫综合征(ARDS)伴弥漫性肺泡损伤,肝脏中转基因的表达极少,器官中没有AAV9抗体或效应T细胞反应的证据。这些结果表明,在接受大剂量rAAV递送的CRISPR基因编辑治疗的晚期DMD患者中,高剂量rAAV引起的强烈先天性免疫反应导致了急性呼吸窘迫综合征(ARDS),这也是学界首次报道基因治疗引发ARDS导致的患者死亡。
LNP递送系统
虽然基于病毒载体的递送系统已将基于CRISPR递送至患者体内,但其疗效可能仍受到预先存在的免疫、有效载荷大小、难以重复给药和不必要的长期表达等限制。这些缺点推动了对包括LNP-mRNA在内的非病毒递送系统的研究。与AAV一样,LNP的安全、疗效和亲和性取决于其纳米级结构。因此,已创建了一套多样化的LNP化学物质,并对其递送基因编辑药物的能力进行了测试。
LNP的化学结构影响mRNA的递送
LNP构成了第二类临床相关的药物递送系统。目前已有三款基于LNP-RNA的疗法获得FDA批准,分别是治疗转甲状腺素蛋白淀粉样变性(ATTR)的Patisiran,通过静脉注射向肝细胞递送小干扰RNA(siRNA),以及两款新冠mRNA疫苗。
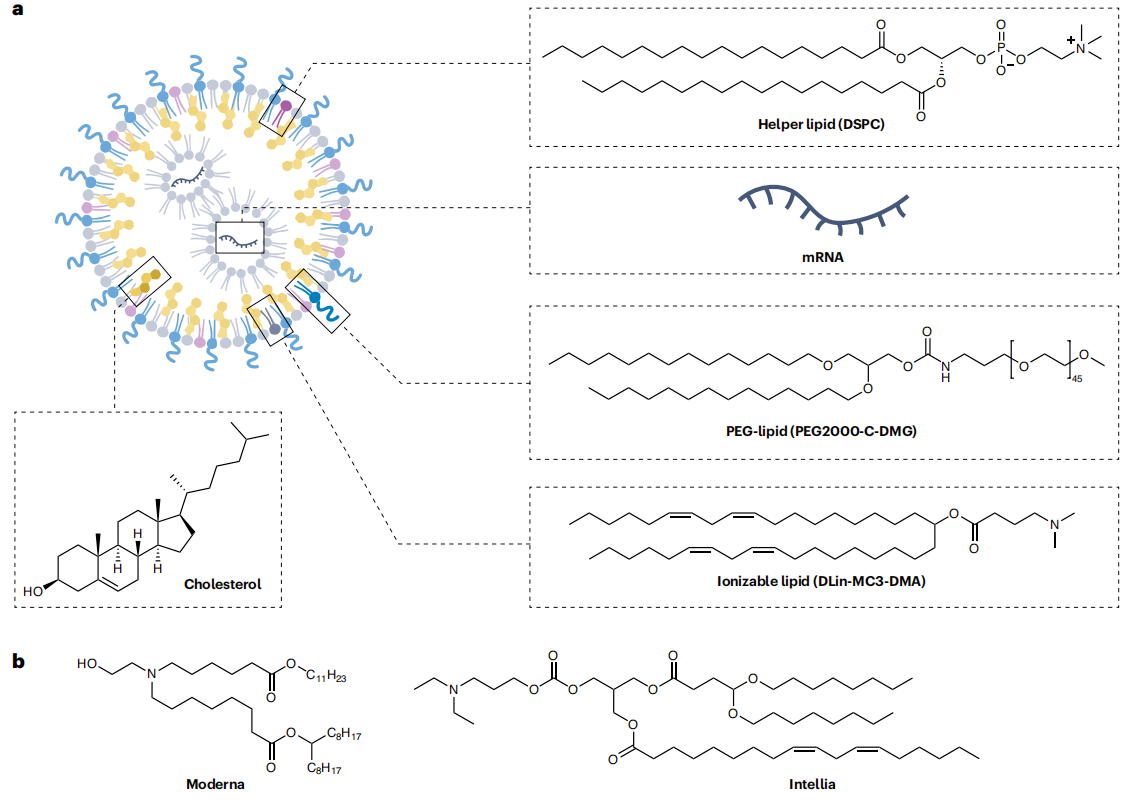
获批的LNP由四种成分组成:阳离子或可离子化脂质、聚乙二醇(PEG)-脂质、胆固醇,以及辅助脂质。这些成分中的每一种都通过不同的机制影响递送。例如,可离子化脂质结构部分受其亲水性成分与疏水性成分的比例控制。这些比例通过控制细胞表面膜和细胞内囊泡的相互作用影响递送。而改变胆固醇、PEG-脂质或辅助脂质也会影响递送。已获批的三款基于LNP-RNA的疗法的LNP均由未修饰的胆固醇制成,但最近有研究显示出在细胞系和小鼠中胆固醇依赖性改善mRNA递送。PEG-脂质也改变了向肝脏递送siRNA以及向肺和眼睛递送mRNA。改变PEG-脂质可能改变它锚定在LNP疏水区的锚定方式,从而改变它从血液中的LNP中被移除的速率。
2022年6月,James Dahlman 等人在 Nature Nanotechnology 发表论文,开发了一种名为单细胞纳米颗粒靶向测序(SENT-seq)技术,使用SENT-seq,能够识别表现出不同LNP摄取能力的细胞亚型以及与这些亚型相关的基因,这可使临床前纳米颗粒载体研究更具预测性,并有望加速mRNA疗法的发展。

图6:单细胞纳米颗粒靶向测序技术用于高通量、单细胞分辨率的体内LNP筛选
LNP介导的临床基因编辑
FDA批准的LNP-mRNA疫苗已用于超过10亿人。这些药物产生稳定的新冠病毒的刺突蛋白,从而启动免疫系统识别和清除新冠病毒,降低了接种者后续接触野生型新冠病毒或其突变株后的病毒载量、发病率和死亡率。随着LNP-mRNA制造的大幅扩大,它们还使未来开发LNP-mRNA药物的可能性更大。大规模生产和使用LNP的能力在很大程度上是由于其化学简单性。两种LNP-mRNA疫苗均由可电离脂质或阳离子脂质、胆固醇、PEG-脂质和辅助脂质配制而成。这种四组分LNP也用于一种siRNA药物Patisiran,用来治疗转甲状腺素蛋白淀粉样变性(ATTR),Patisiran只需每3周给药一次,而没有改变其安全性、药代动力学或药效学。
除了四组分外,FDA批准的可电离脂质还具有两个化学特性,第一个是酯键赋予的生物可降解性。第二个是可电离性,可以通过插入一个胺基(通常是叔胺)至少两个碳原子远离其最近的氧原子来赋予。当使用微流控制备LNP时,胺在低pH缓冲液中成为阳离子,从而促进与核酸阴离子磷酸二酯骨架的静电相互作用。这些相互作用允许大规模微流控LNP配方。
图7:FDA批准的LNP的四种组分
值得一提的是,Verve 公司启动了一项临床试验,使用LNP递送腺嘌呤碱基编辑器(ABE)使PCSK9失活,从而治疗杂合子家族性高胆固醇血症。高胆固醇血症患者表现出LDLR表达下降,这可能导致高LDL-C血清浓度和随后的心脏病。由于PCSK9是LDLR的负调节器,其失活会增加了LDLR表达,从而使LDL-C水平恢复到健康范围。
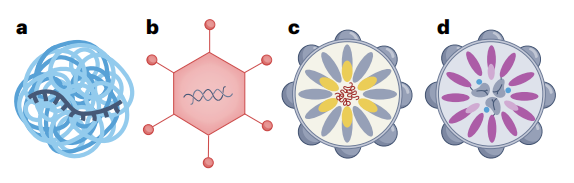
图8:递送基因编辑器的非AAV和非LNP的递送系统,从左至右依次为聚合物纳米颗粒、腺病毒、SEND、工程化VLP
#未来的方向和挑战
从2025年开始,FDA可能会每年批准10-20种基因疗法。因此,FDA发布了指以帮助公司描述其药物产品和设计临床试验,包括针对基因组编辑的具体指南。这些指南强调了在开发基于CRISPR的治疗性基因组编辑疗法时必须考虑的关键问题。
首先,基因编辑器及其递送载体的设计必须尽可能简单。在某些情况下,不含靶向配体的纳米颗粒递送在剂量足够低的情况下可能有效。然而,某些细胞类型可能需要主动靶向。在考虑添加活性靶向配体时,重要的是要了解对趋向性或特异性的改善是否值得增加的复杂性。FDA指南的第二个要点是核酸酶表达的重要性,这通常由递送载体决定。指南指出,更长时间的核酸酶表达可能与意料之外的基因组修饰的更大风险相关。虽然没有明确说明,但长时间核酸酶表达可能需要更长期的安全性研究。最后,FDA还将要求进行广泛的体内递送表征;除了了解局部和全身毒性外,可能还需要对基因编辑器的分布、持久性和清除及其下游基因编辑活性进行严格的表征。
所有这些参数都需要在靶向和非靶向组织中进行测量,包括肝脏和生殖细胞组织。为了避免临床前研究后期出现不必要的意外,在小鼠中优化的靶向和非靶向给药必须在非人灵长类动物中进行的相应研究中得到确认。因此,急需了解不同物种的给药方式是如何变化的,必须继续开发物种不可知性的给药筛选方法。
将基因编辑组分递送至肝外组织仍然具有挑战性。而最近设计靶向非肝组织的纳米颗粒的努力已越来越成功。许多小鼠数据和越来越多的非人灵长类数据表明,在静脉给药后,向肺部和免疫系统(包括造血干细胞)进行临床相关的递送可能是可行的。
本文中讨论的每种基因编辑器的递送系统都有重要的局限性。例如,大剂量AAV治疗可能导致不良事件,这强调了设计具有强有力递送功能的AAV衣壳的重要性,以便使用更低的AAV载体剂量。实现这一目标可能需要跨物种筛选衣壳,以了解大型动物和临床趋向性如何重现临床前数据。降低AAV载体的免疫原性,以及给药后降低患者免疫反应的努力,也可能增强治疗安全性和疗效。
新型递送系统,例如VLP,可能克服其中一些挑战,特别是在患者存在内源性人类衣壳蛋白的情况下,这些蛋白可能受到预先存在的免疫耐受的影响;然而,这些系统需要进一步研究。此外,在减少脱靶效应的努力中,基因编辑器表达的持续时间仍然是一个问题,这可能表明递送RNA的载体更适合实现瞬时CRISPR效应物表达。实际上,即使是使用这些纳米颗粒来递送RNA,也需要进一步研究。例如,有研究显示,对LNP-RNA疗法也会产生免疫反应。
#展望
如果在递送策略和基因编辑有效载荷的优化方面继续取得进展,可以想象,肝外组织可能会成为具有安全治疗指数的患者的靶向组织。值得注意的是,实现对单个组织的有效递送可以转化为对许多疾病的有效治疗,因为基于CRISPR的药物可以调控几乎任何序列。这些药物的模块化及其产生真正临床影响的潜力,强调了考虑基因编辑器如何与其递送系统相互作用的重要性。
论文链接:https://www.nature.com/articles/s41573-023-00762-x
来源:生物世界
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。