产业讯息丨FDA批准首款AADC缺乏症AAV基因治疗药物上市
Release Time: 2024-11-14
2024年11月13日,PTC Therapeutics 宣布其治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD)的AAV基因治疗药物获美国食品药品监督管理局(FDA)批准上市。据悉,这是美国首次批准直接向大脑给药的基因疗法。该疗法名为 KEBILIDI™(eladocagene exuparvovec-tneq),适用于儿童和成人患者。2022年11月这款基因治疗以Upstaza™在英国获批上市,是一种基于重组腺相关病毒血清型2 (AAV2) 的基因疗法。(AAV基因疗法最新盘点丨全球已上市的8款AAV基因疗法)

KEBILIDI™是一种以2型腺相关病毒(AAV2)为载体的体内基因治疗药物,患者由于编码AADC酶的基因出现突变而致病,AAV2携带编码AADC酶的健康基因,以基因补偿的形式达到治疗效果。通过立体定向外科手术进行给药,理论上一次给药长期有效。
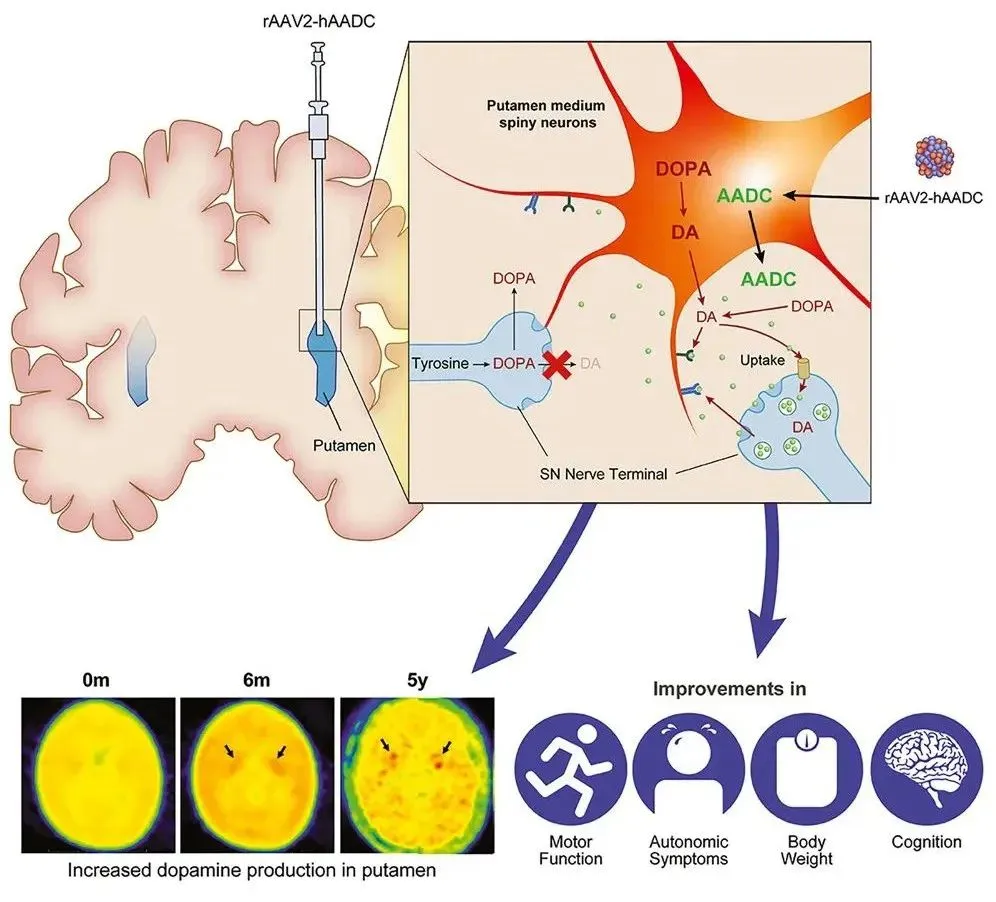
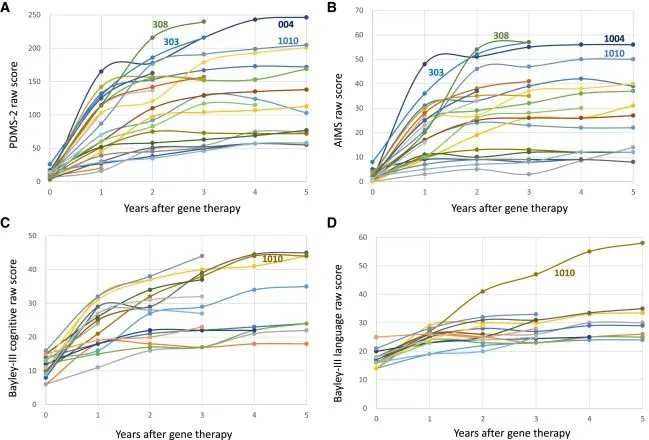
KEBILIDI可显著提高多巴胺生产,并且改善患者多种功能指标
图源:Molecular Therapy
来源:细胞与基因治疗领域
【声明】本文为转载文章,本平台仅作分享、传递信息,版权归原作者所有,如有侵权,请联系删除。